Мета роботи: Ознайомитися з методом культивування мікроорганізмів в лабораторних умовах
Теоретичні основи:
Культивування мікроорганізмів на поживних середовищах здійснюють різними методами. Вибір методу вирощування мікроорганізмів багато в чому залежить від типу їх харчування та дихання.
Мікроби одного виду, отримані на поживних середовищах, називають чистими культурами, а сукупність, клітин, що походять з однієї клітини, отримала назву клона.
Зберігання чистоти культур, які вивчаються, є важливою вимогою. Тому поживні середовища, які використовуються для пересіву культур, повинні бути стерильними, а розлив середовищ та посів культур повинні проводитися в асептичних умовах.
Методи розливу поживних середовищ
Мікроорганізми культивують у пробірках, колбах, чашках Петрі, матрацах та іншому посуді. Поживні середовища розливають безпосередньо з колб та пляшок або за допомогою піпеток. Для забезпечення стерильності розлив середовищ проводять біля полум’я пальника в радіусі не більше 10 – 15 см від його центру. Щільні поживні середовища перед розливом розплавлюють на водяній бані та охолоджують до температури 50 - 60 °С.
При розливі середовища у чашки Петрі посудину з середовищем беруть у праву руку та, тримаючи її біля вогню, лівою рукою виймають пробку (затиснувши її мізинцем). Обпалюють горлечко посудини та, злегка відкривши лівою рукою кришку чашки, вводять під неї горлечко, не доторкаючись до краю чашки. У кожну чашку наливають 15 - 20 мл середовища (шаром 2 - 3 мм), розподіляючи середовище рівномірно по дну чашки. Якщо при цьому на поверхні середовища утворюються пухирці повітря, до них підносять полум'я горілки або сірника ще до того, як середовище застигає - пухирці щезнуть. Потім кришку закривають та дають середовищу застигнути. Якщо посів виконують у день розлива, середовище необхідно підсушити. Для цього чашки в термостаті обережно відкривають та встановлюють кришки та чашки дном доверху. Чашки витримують у термостаті 20 – 30 хвилин.
У пробірки розливають середовища по 3 - 5 мл або по 10 мл. Для приготування скошеного агару пробірки зі стерильним розплавленим агаровим середовищем укладають у нахиленому положенні (приблизно під кутом 20°), щоб середовище не заходило за 2/3 висоти пробірки, інакше воно може змочити пробку. Після того, як середовище застигне, пробірки ставлять вертикально та дають стекти воді (конденсату). У колби, матраци та пляшки розливають середовища на 2/3 їх ємності.
Методи посіву мікроорганізмів
У залежності від характеру посівного матеріалу та середовищ існують різні методи посіву. Усі вони переслідують одну ціль: посіяти матеріал таким чином, щоб з оточуючого середовища у нього не попали сторонні мікроорганізми. Тому під час посіву не можна робити різких pyxiв та розмовляти. Найкраще проводити посіви у спеціальних приміщеннях - боксах.
1. Посів з пробірки в пробірку
Пробірки з посівним матеріалом та пробірку з середовищем тримають трохи нахилено у лівій руці між великим та вказівним пальцями так, щоб краї пробірок були на одному рівні, а їх основи знаходились поверх кисті. Петлю вертикально прожарюють, тримаючи правою рукою у полум’ї пальника. Пробки з пробірок виймають правою рукою, затискаючи їх між мізинцем та долонею.
Вийнявши пробки, обпалюють краї пробірок у полум’ї пальника. Прожарену петлю вводять через полум'я пальника у пробірку з посівним матеріалом, охолоджують та, набравши невелику кількість посівного матеріалу, обережно переносять його у пробірку з середовищем.
При посіві на рідке середовище петлю злегка занурюють у рідину та розтирають посівний матеріал по стінці пробірки, після чого змивають його середовищем. При посіві на скошений агар матеріал розтирають на поверхні середовища зигзагоподібними рухами знизу вверх, починаючи від межі конденсаційної води.
Якщо посів проводиться на агарові або желатинові середовища, розлиті у пробірки стовпчиком, то петлею з посівним матеріалом проколюють стовпчик до дна, проводять так званий посів уколом. Після посіву петлю виймають з пробірки, краї пробірок обпалюють та, провівши пробки через полум'я горілки, пробірки закривають, а петлю прожарюють.
Посів рідкого матеріалу можна проводити стерильними пастеровськими або градуйованими піпетками. Крім того, для посіву можна використовувати тампон з досліджуваним матеріалом. При посіві на рідкі середовища тампон занурюють у середовище та декілька секунд ополіскують у ньому. При посіві на щільні поживні середовища матеріал з тампона ретельно втирають у поверхню середовища, обертаючи тампон.
2. Пересів на пробірки з чашки Петрі
Великимта вказівним пальцями лівої руки злегка відкривають кришку та вводять під неї обпалену петлю. Набравши посівний матеріал, петлю виймають з чашки та закривають її. У ліву руку беруть пробірку з середовищем. Посів проводять так само, як з пробірки в пробірку. Після посіву чашку перевертають дном доверху.
3. Посів шпателем на чашки Петрі з агаром
Піпеткою, петлею або скляною паличкою наносять па поверхню середовища посівний матеріал та ретельно втирають його круговими рухами шпателя доти, доки шпатель не перестане вільно ковзатись по поверхні агара. Лівою рукою при цьому притримують кришку та одночасно обертають чашку. Після закінчення посіву скляний шпатель опускають у дезінфікуючий розчин, а металевий - прожарюють у полум'ї пальника, засіяну чашку перевертають дном доверху.
4. Посів петлею на чашки Петрі з агаром
Невелику кількість посівного матеріалу зигзагоподібними рухами розподіляють по всій поверхні чашки, після закінчення посіву закривають чашку та пропалюють петлю.
5. Посів на сектори
Чашку зі сторони дна розкреслюють на сектори. Посів проводять зигзагоподібними рухами від краю чашки до центру. При ньому необхідно слідкувати, щоб штрихи не заходили на сусідній сектор. Чашку закривають та перевертають дном доверху.
6. Посів на агарові середовища тампоном
Злегка відкривши кришку, вносять у чашку тампон та рухами по колу втирають його вміст у поверхню середовища, обертаючи при цьому тампон і чашку. Чашку закривають та перевертають дном до верху.
7. Посів на агарові середовища газоном
Приблизно 1 мл рідкої культури (якщо культура вирощена на щільному середовищі, її емульгують у фізіологічному розчині або бульйоні) наносять піпеткою на поверхню агару та ретельно розподіляють рідину по поверхні середовища. Чашку злегка нахиляють та піпеткою відсмоктують надлишок культури, виливаючи його у дезінфікуючий розчин. Туди ж вміщують піпетку.
8. Посів в товщу щільного середовища
Культуру, вирощену в рідкому середовищі, або суспензію мікробів вносять піпеткою в склянку з розтопленим та охолодженим до 45 оС агаровим середовищем, переміщують та виливають у стерильну чашку Петрі. Після застигання агару чашки перевертають дном доверху. Для посіву й товщу агару можна також внести посівний матеріал у порожню стерильну Чашку Петрі та залити 15 – 20 мл охолодженого до 45 оС агару. Для переміщування вмісту чашки її злегка похитують або обертають. Після застигання середовища чашку повертають дном доверху.
Посів у флакони, колби, матраци та пляшки проводять приблизно так само, як в пробірки, тільки спочатку набирають посівний матеріал, а потім відкривають пробірку в посудині з середовищем. Після посіву чашки, флакони надписують: пробірки - у верхній частині, чашки - зі сторони дна.
Засіяні середовища розміщують в умови, які забезпечують життєдіяльність мікроорганізмів. До таких умов відносяться температурний режим, вологість, аерація, світло та інші фактори.
Вирощування мікроорганізмів проводять в спеціальних шафах - термостатах або термостатованих кімнатах, у яких підтримується відповідна температура. Більшість мікроорганізмів розвивається при оптимальній температурі 25 - 37 °С. Вони належать до мезофілів. Верхня межа для них складає приблизно 38 - 45 °С.
Існує група мікроорганізмів - психрофілів, які розвиваються у межах від -20 до +20 °С.
Теплолюбні організми - термофіли - витримують нагрівання до 70 оС. Однак оптимальною температурою для їх росту є температура 45 – 65 оС.
Для розвитку мікроорганізмів необхідно підтримання певної вологості середовища. Мінімальний вміст вільної води, при якому ще можливий розвиток більшості бактерій, дорівнює 20%. Тому тривале зберігання культур на щільних середовищах як при кімнатній температурі, так і в холодильнику небажано, боце приводить до підсихання середовища та загибелі мікроорганізмів.
Більшість мікроорганізмів не потребує освітлення при культивуванні. Світло необхідно при вирощуванні фототрофних мікроорганізмів, які використовують енергію світла в процесах обміну речовин. З цією метою звичайно використовують лампи розжарювання потужністю 75 – 100 Вт.
Важливе значення при вирощуванні мікроорганізмів має тривалість культивування. Більшість бактерій культивується протягом 18 - 24 годин при температурі 37 оС. Гриби вирощують при температурі 28 - 30 °С протягом двох діб. Актиноміцети при такій самій температурі ростуть 3 - 5 діб.
Матеріали, реактиви й устаткування:
ΜΠА в колбах, МПБ в колбах, середовище Чапека, стерильні чашки Петрі, пробірки, піпетки, бактеріологічні петлі, культури мікроорганізмів Вас.subtiiis, E. coli, Sarcina flava, Staph. aureus, сірники, сухе пальне, пальники, спирт, шпателі, тампони.
Хід роботи:
1. Опанувати техніку розливу поживних середовищ у колби, чашки Петрі, пробірки.
2. Опанувати основні методи посіву мікроорганізмів:
- у чашки Петрі бактеріологічною петлею;
- шпателем на чашки Петрі;
- на сектори;
- тампоном;
- у посуд зі щільним поживним середовищем;
- піпеткою в рідке поживне середовище.
Контрольні питання:
1. В чому полягає вибір методу культивування мікроорганізмів?
2. Метод культивування аеробних мікроорганізмів в лабораторних умовах.
3. Метод культивування анаеробних мікроорганізмів в лабораторних умовах.
Форма звітного бланка до лабораторної роботи № 10.
| Група | Курс | Лабораторна робота № 10 | ||||
| Культивування мікроорганізмів | ||||||
| Прізвище студента | ||||||
| 1) Відповідь на контрольні питання 2) Висновки по лабораторній роботі №10 | ||||||
| Роботу прийняв | Дата | Підпис | ||||
Лабораторна робота № 11
Підрахунок клітин мікроорганізмів під мікроскопом
Мета роботи: Ознайомитися з методикою підрахунку клітин мікроорганізмів під мікроскопом за допомогою камери Горяєва-Тома
Теоретичні основи:
Підрахувати клітини мікроорганізмів під мікроскопом можна, використовуючи рахункові камери, капіляри Перфильева, препарати фіксованих і пофарбованих клітин, приготовлені на предметних стеклах або мембранних фільтрах. Перераховані методи дозволяють визначити загальна кількість клітин в одиниці об'єму. Варто пам'ятати, що підраховуються всі клітки, як живі, так і мертві. Основне обмеження більшості зазначених методів - необхідність досить високих концентрацій клітин в одиниці досліджуваного субстрату.
Підрахунок клітин у рахункових камерах.
Цей метод рекомендується використовувати для підрахунку великих об'єктів - дріжджів, одноклітинних водоростей, конідій грибів і деяких великих бактерій. Зазвичай використають камеру Горяева -Тома (рисунок 11.1), хоча можна застосовувати й інші рахункові камери.
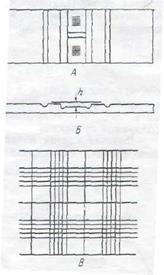
А – вид з верху; Б – вид з боку
В – при малому збільшені мікроскопу.
Рисунок 11.1 – Підрахункова камера Горєва – Тома
Камера Горєва являє собою товсте предметне скельце розділене бороздками. На центральну частину скельця нанесена сітка. Площа квадрату сітки вказана на одній із сторін предметного скельця і складає 1/25 мм2 (великий квадрат) або 1/400 мм2 малий квадрат. Частина предметного скельця на якій розташована сітка на 0,1 мм нижче двох інших сторін. Це глибина камери.
При роботі з камерою необхідно підтримувати визначений порядок її заповнення. По-перше, заглиблення сіткою покривають спеціальним шліфованим покривним скельцем до появлення кілець Ньютона (ретельно притирають покривне скельце до сторін камери. Далі камеру заповнюють суспензією мікроорганізмів яку вносять крізь бороздку камеру капіляром або піпеткою. Підрахунок клітин починають через 3-5 хвилин після заповнення камери. Цей час необхідне для того, щоб клітини осіли і при підрахунку були видимі в одній площині. Кількість клітин підраховують з об’єктивом 8× та 40×. Підраховують клітини в 10 великих або 20 маленьких квадратах сітки, переміщаючи останні по діагоналі. Підраховують всі клітини, що лежать в квадраті сітки, а також клітини, що пересікають верхню і праву сторону квадрату. Кількість клітин в великому квадраті не повинна перевищувати 20, а в малому 10. В протилежному випадку суспензію розводять водопровідною водою. Для отримання достовірного результату, загальна кількість підрахованих клітин повинна бути не менше 600. Підрахунок клітин повторюють 3-4 рази при цьому кожний раз камеру монтують заново і заповнюють дріжджовою суспензією.
Кількість клітин в 1 мл суспензії розраховують по формулі
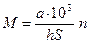 , (11.1)
, (11.1)
де М – кількість клітин в 1 мл суспензії;
а – середня кількість клітин в квадраті сітки;
h – глибина камери в мм;
S – площа квадрату сітки в мм2;
103 – коефіцієнт переводу см3 в мм3;
n – розведення суспензії мікроорганізмів.
Матеріали, реактиви й устаткування:
Дріжджі хлібопекарські Saccharomyces cerevisiaе, камера Горяєва – Тома, мікроскоп, капіляри або піпетки.
Хід роботи:
Провести підрахунок кількості дріжджових клітин в 1 мл суспензії.
Контрольні питання:
1. За допомогою яких методик можна підрахувати кількість клітин мікроорганізмів в певному обсязі?
2. Що собою являє камера Горяєва – Тома?
Форма звітного бланка до лабораторної роботи №11.
| Група | Курс | Лабораторна робота №11 | ||||
| Підрахунок клітин мікроорганізмів під мікроскопом | ||||||
| Прізвище студента | ||||||
| 1) Розрахувати кількість клітин дріжджів Saccharomyces cerevisiaе в 1 мл суспензії за формулою 13.1 2) Відповідь на контрольні питання 3) Висновки по лабораторній роботі № 11 | ||||||
| Роботу прийняв | Дата | Підпис | ||||
Лабораторна робота №12






