Производные циклогексана являются наиболее распространенными в природе соединениями. Его структура входит в состав молекул терпенов, стероидов и алкалоидов. Циклогексан и его гомологи содержатся в некоторых нефтях и нефтепродуктах.
Циклогексан и его алкил производные получают гидрированием ароматических соединений над платиной или никелем (Сабатье)

В отсутствие водорода равновесие полностью сдвинуто в сторону образования бензола. Следует отметить, что дегидрогенизация гомологов циклогексана происходит в значительно более жестких условиях.
Для производных циклогексана характерны те же реакции, что и для функцианализированных алкенов.
Циклогексен может быть получен из циклогексанола любой реакцией дегидратации применяемой для алифатических спиртов. В промышленности его получают каталитической дегидратацией пропусканием паров под Аl2O3 при 350-400ºС.
Одной из особенностей химического поведения циклогексана является то, что он в присутствии платинового или палладиевого катализатора необратимо диспропорционируется на бензол и циклогексан в результате экзотермической реакции (необратимый катализ Зелинского)

По всей вероятности, это превращение является одной из промежуточных стадий дегидрогенизации циклогексана, когда выделяющийся водород гидрирует циклогексен.
Циклогексен обладает всеми свойствами алифатических алкенов и может быть гидрирован, эпоксидирован, галоидирован, гидрогалогенирован и т.д.
Циклогексадиен имеет сопряженную систему двойных связей, вступает в реакцию Дильса-Альдера и относится к типичным диенам.
Гидроксипроизводные циклогексана получают каталитическим гидрированием соответствующих ароматических гидроксипроизводных

Другой путь получения циклогексанола – это, классический способ гидратации олефинов, катализируемой кислотами:

Как и в случае алифатических спиртов окисление циклогексанола мягкими окислителями (реагентом Коллинза) приводит к получению циклогексанона

При окислении сильными реагентами происходят более глубокие превращения, рассмотренные в следующем разделе.
Гексагидроксипроизводные циклогексана образуют целый класс инозитов, состоящих из 8 геометрических изомеров подобно гексахлорциклогексану
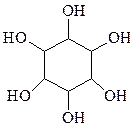
Эти соединения широко распространены в природе и в виде производных содержатся в мышцах и различных органах животных, в семенах растений, микроорганизмах. Некоторые из них применяются в медицине.
Кроме окисления циклогексанола мягкими окислителями циклогексанон может быть получен каталитическим окислением самого циклогексана, хотя этот путь осложняется деструкцией кольца.
При окислении сильными окислителями HNO3, KMnO4, H2Cr2O7 циклогексанон образует с хорошим выходом адипиновую кислоту, а при окислении органическими надкислотами или кислотой Каро – капролактон (реакция Байера-Виллигера)

Циклогексанон и его производные под действием ультрафиолетового света в присутствии воды размыкаются с образованием капроновой кислоты или, в случае, например, α -метилциклогексанона – гептановой кислоты

Механизм реакции аналогичен фотолизу кетонов алифатического ряда и состоит в гомолитическом разрыве углерод-углеродной связи и образовании кетена, который присоединяя воду дает кислоту

1,1-Диметилциклогексадиен-3,5 (димедон) является, подобно малоновому эфиру, метиленактивным соединением и легко вступает в реакцию 1,2- и 1,4-присоединения к электрофилам. Он получается взаимодействием окиси мезитила и малонового эфира в присутствии сильного основания в результате двух последовательных реакций Михаэля и Кляйзена

Взаимопревращения циклов
Функциональным производным циклических соединений свойственна способность вступать в реакции, изменяющие размер первоначального цикла.
К реакциям расширения цикла склонны производные циклопропана и циклобутана. Расширение цикла может происходить за счет включения одного из атомов боковой цепи или внедрения реагента по связи С-С.
Дегидратация спиртов алициклического ряда часто сопровождается изменением размера цикла, например

Помимо использования сильных кислот в этих превращениях могут применяться кислоты Льюиса (ZnCl2 и AlCl3).
Изменением размера цикла в ту или другую сторону сопровождаются и реакции дезаминирования алициклических аминов азотистой кислотой

Аналогичный результат можно получить и при пинаколиновой перегруппировки вицинальных диолов ряда циклопропана или циклогексана


При нагревании с хлористым алюминием алициклические производные также претерпевают сокращения или расширения циклов. В случае метилциклопентана этот синтетический переход находится в равновесной форме

При 70-800С равновесие устанавливается при соотношении циклогексана и метилциклопентана 3:1.
В этих условиях метилциклобутан необратимо превращается в циклопентан

Циклические α -хлоркетоны при обработке щелочами претерпевают сокращение цикла, гладко превращаясь в циклоалканкарбоновые кислоты

При фотохимическом или каталитическом разложении диазосоединений в присутствии циклических кетонов происходит внедрение карбена по углерод-углеродной связи цикла, приводящее к его расширению

Следует отметить, что реакции разрыва мостиковой углерод-углеродной связи в конденсированных полициклических соединениях также протекают с расширением цикла







