В ароматических соединениях в бензольном кольце могут размещаться разнообразные заместители. По их влиянию на реакции электрофильного замещения они были сведены в две группы. Оказалось, что одни заместители способствуют реакциям этого типа и направляют новые заместители в о - и п -положения по отношению к имеющемуся заместителю. Такие заместители были отнесены к заместителям 1 рода или, более конкретно, электронодонорным. Другие заместители составили список замесителей 2 рода или электроноакцепторных. Однако при ближайшем рассмотрении отнесение заместителей к донорам или акцепторам электронов вызывает определенное внутреннее сопротивление. Обратимся к конкретному примеру.
По принятой классификации, гидроксильная группа является одним из наиболее сильных электронодонорных заместителей. Между тем, имеющаяся в фенолах связь С–О -это связь между атомами, значительно различающимися по электроотрицательности. Благодаря этому электроны ковалентной пары этой связи смещены в сторону более электроотрицательного кислорода С:О (- I –эффект, индуктивный эффект) и гидроксильную группу в фенолах следовало бы отнести к электроноакцепторным заместителям. Однако то, что гидроксил в фенолах донор электронов – это неоспоримый факт. Отсюда следует, что существует, по-видимому, и другой способ передачи электронов от гидроксильной группы к бензольному кольцу, который не только компенсирует – I –эффект кислорода гидроксила, но и делает его донором электронов. Таким эффектом является мезомерный эффект (+ М –эффект), обусловленный способностью кислорода обобщить с кольцом более чем одну пару электронов и принять на себя положительный заряд.
Рассмотрим в качестве примера электрофильное п -замещение с участием фенола. При этом на лимитирующей стадии получится σ -комплекс, представляющий собой резонансный гибрид нескольких канонических структур

Оказывается, что кроме указанных очевидных структур, в гибридизации принимает участие еще одна структура, в которой положительный заряд размещен на атоме кислорода

Такой ион отличается особой устойчивостью, поскольку в этой структуре каждый атом имеет полный октет электронов. Именно благодаря участию в гибридизации этого устойчивого иона σ -комплекс при электрофильном замещении фенолов тоже приобретает стабильность.
Таким образом, гидроксильная группа за счет индукционного эффекта оттягивает электроны от бензольного кольца, а за счет противоположно направленного мезомерного эффекта – подает электроны к кольцу. При этом мезомерный эффект превалирует над индукционным эффектом и в целом гидроксил выступает как донор электронов.
Аналогично складывается ситуация в случае аминов

Сложнее обстоит дело в случае галогенов, например, хлора. Как уже отмечалось, этот заместитель, в отличие от других заместителей 1 рода, в реакциях электрофильного замещения ведет себя необычно: новые заместители направляет в о - и п -положения, однако затрудняет реакцию.
Рассмотрим реакцию электрофильного п -замещения хлорбензола. И в этом случае реакция идет с образованием на лимитирующей стадии σ -комплекса, представляющего собой резонансный гибрид нескольких канонических структур
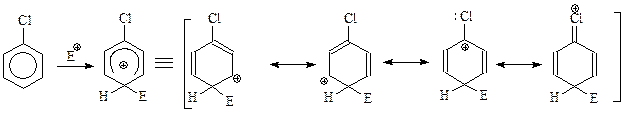
Из приведенных формул видно, что в хлорбензоле, как и в случае участия в реакции анилина и фенола, заместитель оттягивает электроны от бензольного кольца за счет индуктивного эффекта и одновременно подает электроны за счет мезомерного эффекта. Если станем бездумно складывать или вычитывать эти разнонаправленные эффекты, мы не сумеем объяснить наблюдаемое влияние хлора на реакционную способность и ориентацию. Так, если допустить, что в рассматриваемом случае мезомерный эффект превалирует над индукционным эффектом, то становится понятным о - и п -ориентация, однако с допущением не согласуется изменение реакционной способности. Если же думать, что индукционный эффект более существенен, чем мезомерный, то это объяснит уменьшение реакционной способности, но не ориентацию. Выход из положения был предложен поистине удивительный, хотя, может быть, и единственно возможный. Предполагается, что при электрофильном замещении с участием галогенбензолов за ориентацию отвечает мезомерная подача электронов к кольцу, а за реакционную способность – индукционное оттягивание электронов от кольца.
Глава 12
АРИЛГАЛОГЕНИДЫ
В соединениях, содержащих бензольное кольцо, атомы галогена могут находиться в кольце или же в боковой цепи. Обычно к арилгалогенидам относят только соединения первого типа. Это, вполне оправдано, поскольку соединения с галогеном в боковой цепи, как по способам получения, так и химическим свойствам, напоминают уже рассмотренные галогеналканы.
Среди арилгалогенидов, а они могут содержать в кольце и другие функциональные группы, наиболее часто встречаются следующие
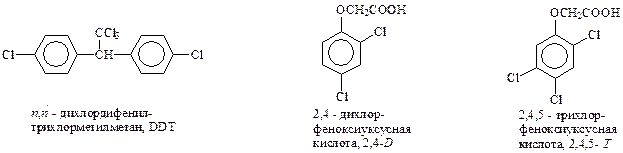
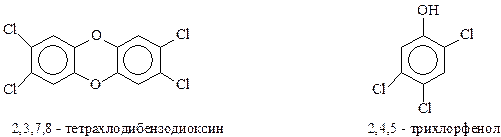
Из приведенных названий можно видеть, что названия соединений составляются с использованием обычных правил тривиальной, рациональной или же систематической номенклатур.
Методы получения
Прямое введение галогена в ароматическое кольцо. Для получения простейших арилгалогенидов, прямое введение галогена в реакциях хлорирования и бромирования аренов является, по-видимому, наиболее подходящим методом. Галогенирование аренов происходит в присутствии катализаторов, чаще всего – кислот Льюиса: FeCl3, AlCl3 и др. При хлорировании избытком хлора реакция идет вплоть до гексахлорбензола
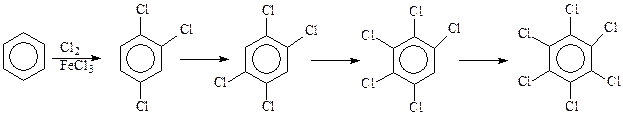
Подбором условий проведения реакции можно получить любой из хлорбензолов, представленных в схеме.
Аналогично протекает бромирование бензола и других аренов.
Иодирование ароматических соединений может происходить и без использования обычных в таких случаях катализаторов, однако оно идет лишь при участии в реакции активных исходных продуктов, таких как фенолы и амины. Сам бензол и алкилбензолы иодом непосредственно не иодируются. Реакцию удается осуществить лишь при её проведении в условиях, когда иодистоводородная кислота, выделяющаяся при иодировании, сразу же окисляется и разрушается. Для этого реакцию проводят в присутствии иодноватой кислоты или нитрующей смеси.
Фторпроизводные бензола также не удается получить прямым фторированием. Из-за чрезмерной активности фтора реакция идет до четырехфтористого углерода и фтористого водорода.
Получение арилгалогенидов через соли диазония. Этот метод характеризуется универсальностью. Через соли диазония (этот класс соединений будет рассмотрен дальше) могут быть получены все возможные арилгалогениды. Сами соли диазония синтезируются из первичных аминов реакцией с азотистой кислотой (соляная кислота и нитрит натрия). Соли диазония в условиях реакции Зандмейера диазогруппу замещают на хлор или бром


Особенно ценно то, что через соли диазония с хорошими выходами можно получить йод- или фторбензолы

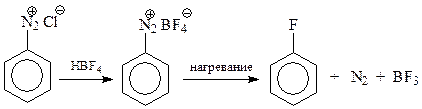
Как видно из приведенной схемы, при синтезе фторпроизводных вначале получают борфторид диазония, который затем при нагревании дает арилфторид, азот и трехфтористый бор (реакция Шимана).
Использование различных реакций. Очень часто важнейшие с точки зрения практического использования галогенпроизводные аренов получают дальнейшими трансформациями более простых арилгалогенидов. Рассмотрим несколько примеров.
Первым из органических соединений, положившим начало химической войне с вредными насекомыми, был ДДТ. Инсектицидные свойства ДДТ были установлены еще в 1937 г (Мюллер), а промышленное применение начато в 1942 г. (Швейцария). ДДТ получается конденсацией хлорбензола с трихлоруксусным альдегидом в присутствии H2SO4 (Цейдлер, 1874 г.)

В настоящее время ДДТ как инсектицид не применяется.
Широко используемое средство борьбы с сорной растительностью (гербицид) – 2,4-дихлорфеноксиуксусная кислота получается реакцией Вильямсона из 2,4-дихлорфенолята натрия и монохлоруксусной кислоты
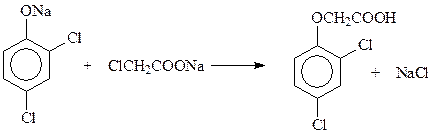
Аналогично из 2,4,5-трихлорфенола и монохлоруксусной кислоты получается еще один представитель гербицидов – 2,4,5-Т

Следует отметить, что смесь бутиловых эфиров 2,4-Д и 2,4,5-Т, под названием «оранжевый препарат», использовался армией США в войне против Вьетнама (1962-71 г.) для уничтожения растительности, лесов и посевов риса.
Производные 2,4,5-трихлорфенола используются для обработки семян хлопчатника, для защиты лесов от вредителей, как исходный продукт при получении 2,4,5-Т. Сам упомянутый трихлорфенол является продуктом щелочного гидролиза 1,2,4,5-тетрахлорбензола (растворитель – смесь этиленгликоля и ксилола, 1600С)
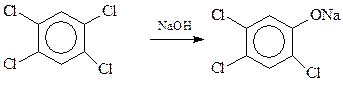
Эта достаточно простая реакция печально известна тем, что ее практическое осуществление часто сопровождается взрывами и химическим загрязнением окружающей среды диоксинами (Севезо в Италии, 1976 г.).
Химические свойства
Химические свойства арилгалогенидов определяются наличием в их молекуле бензольного кольца и атома галогена, а также взаимным влиянием этих структурных факторов друг на друга.
За счет бензольного кольца арилгалогениды способны вступать в реакции электрофильного замещения, которые будут протекать под контролем атома галогена. В предыдущей главе эти реакции были основательно изучены. Основной вывод при этом сводился к тому, что атом галогена затрудняет реакции замещения (- I –эффект галогена) и новые заместители направляет в о - и п -положения (+ М –эффект галогена) кольца.
Рассмотрим реакции арилгалогенидов с участием галогена, протекающие под контролем ароматического кольца.
Известно, что для галогенпроизводных наиболее характерной реакцией является реакция замещения. Атом галогена в виде аниона – хорошая уходящая группа, чем и объясняется склонность его к замещению другим нуклеофилом.
Применительно к арилгалогенидам установлено, что ароматически связанный галоген мало расположен замещаться на другие нуклеофилы, напоминая в этом отношении галогеналкены, в которых галоген связан с углеродом, имеющим двойную связь (sp2 -гибридизованный углерод). Так, хлор в хлорбензоле замещается на гидроксил лишь при исключительно жестких условиях: температуре 3500С, давлении 315 атм., щелочью 10-15% – ной концентрации. Даже в указанных условиях реакция идет длительное время.
Инертность арилгалогенидов в реакциях нуклеофильного замещения связана с тем, что неподеленная пара электронов вступает в сопряжение с секстетом электронов кольца

Это приводит к двоесвязанности галогена и упрочнению связи C-Cl. Сказанное подтверждается данными, полученными при измерении длин связей и дипольных моментов у хлористого этила и хлорбензола
длина связи, нм дипольный момент, D
хлористый этил 0,177 2,05
хлорбензол 0,170 1,76
Двоесвязанность хлора в хлорбензоле особенно наглядно видна при изображении молекулы арилгалогенида в виде резонансного гибрида нескольких канонических структур с разделенными зарядами

Изложенная аргументация свидетельствует о том, что ароматически связанный галоген замещается труднее чем, например, в галогеналканах. Однако реакции этого типа вполне возможны. Приведем конкретные примеры

Из рассмотрения приведенных реакций видно, что на активность арилгалогенидов в реакциях нуклеофильного замещения значительное влияние оказывают и другие заместители, находящиеся вместе с галогеном в бензольном кольце. Особенно, если они относятся к электроноакцепторным заместителям,которые, к тому же, занимают в кольце подходящие места по отношению к атому галогена.
Как же протекает реакция нуклеофильного замещения галогена в арилгалогенидах?
При рассмотрении реакции нуклеофильного замещения галогена в алифатическом ряду были предложены и убедительно обоснованы ставшие классическими механизмы SN 1 и SN 2. Нельзя ли и замещение в ароматическом ряду объяснить с привлечением этих механизмов? Оказывается, нельзя.
Механизм SN 1 предполагает отщепление галогена на лимитирующей стадии с образованием карбокатиона. При нуклеофильном замещении ароматически связанного галогена по этому механизму должен был бы образоваться фенил-катион, отличающийся особой неустойчивостью.
В арилгалогенидах все атомы и связи, кроме облака секстета р -электронов, расположены в одной плоскости. В результате гетеролиза связи С-Сl при замещении возникает вакантная орбиталь, ось которой перпендикулярна к осям р -электронов бензольного кольца. Такая взаимная ориентация осей не дает возможности р -электронам кольца участвовать в делокализации положительного заряда в фенил-катионе

В силу сказанного протекание нуклеофильного замещения галогена в арилгалогенидах через неустойчивый фенил-катион исключается, и мономолекулярный механизм не реализуется.
Бимолекулярный механизм SN 2 предполагает нуклеофильную атаку субстрата с тыла. В случае арилгалогенидов «тыл» у галогена надежно прикрыт бензольным кольцом. Это обстоятельство исключает возможности замещения ароматически связанного галогена в арилгалогенидах и по механизму SN 2.
Из изложенного выше следует, что для случая нуклеофильного замещения ароматически связанного галогена приходится искать иные объяснения, чем те, которые нам известны.
Ключ к пониманию хода реакции в рассматриваемом случае содержится в следующих экспериментальных наблюдениях.
При щелочном гидролизе п -хлортолуола, как и можно было ожидать, получается п -крезол. Но удивительно, он оказывается лишь одним из продуктов реакции. Другим продуктом, получающимся с таким же выходом, неожиданно оказывается м -крезол

Неожиданно здесь то, что новый заместитель занимает не только то место в бензольном кольце, которое раньше занимал галоген, но и соседнее.
Этот пример не является единичным. Было показано, что хлорбензол, в котором хлор связан с углеродом кольца, являющимся изотопом обычного углерода (С14), при взаимодействии с амидом калия в жидком аммиаке, замещает свой хлор на аминогруппу в двух положениях (Робертс, 1953 г.)







