Часть вторая
Циклические соединения
Глава 10
Алициклические соединения
Алифатическими циклическими соединениями, алициклическими соединениями или циклоалканами называются циклические аналоги алканов, образованные замыканием концов алифатической цепи. Понятно, что приставка али- указывает на эту генетическую связь с алифатическими соединениями и отличает их от ароматических соединений. Они также называются карбоциклическими соединениями или карбоциклами в тех случаях, когда необходимо отметить их отличие от гетероциклов.
Алициклы принято делить по числу звеньев на 4 группы:
3 – 4 – звенные - малые циклы
5 – 7 – звенные – обычные циклы
8 - 11 –звенные – средние циклы
12 и более – макроциклы
Названия алициклических углеводородов образуют из названий алифатических соединений с тем же числом атомов углерода путем добавления неотделяемого префикса цикло-.
Первые представители циклоалкананов циклопропан и циклобутан стали известны в 80-х годах ХIХ века.
В соответствии с теорией валентных связей углы между связями в алканах должны составлять 109,47º. Любое отклонение от этой величины сопровождается изменением внутренней энергии. Реально, для большинства алканов эта величина составляет 111-113º. Такое раскрытие углов связано с отталкивающим взаимодействием между водородными атомами несколько напоминающим сопротивление пружины при попытке сблизить ее концы. Таким образом, для замыкания углеводородной цепи в кольцо необходимо приложить определенное усилие, превосходящее это взаимодействие. Какова же природа связей в циклопропане и циклобутане, приводящая к значительным изменениям углов валентных связей?
В 1885г. А. Байер выдвинул теорию напряжения, объясняющую возможность существования алициклических соединений. Считая, что все атомы в цикле находятся в одной плоскости он предположил, что в трехчленном цикле валентные углы составляют 60º, в четырехчленном -90º, в пятичленном -108º, в шестичленном -120º и т.д. Таким образом, мерой напряженности цикла он предложил считать половину разности между тетраэдрическим и валентным углом. По его теории циклы, бóльшие, чем циклопентан и циклогексан, также должны быть неустойчивы, как и малые циклы.
По мере развития химии циклических соединений стали появляться факты, противоречащие этой теории. Одно из главных противоречий – энергии циклов, начиная от пятичленного и выше, оказались приблизительно одинаковым. Это несоответствие с теорией было разрешено доказательством неплоскостного (некапланарного) расположения углеродных атомов кольца, начиная с циклобутана.
Наиболее яркие изменения структуры алкана при его замыкании в цикл отражаются в молекуле циклопропана – это единственный плоский карбоцикл, у которого наименьший эндоциклический и увеличенный экзоциклический валентные углы, несколько укороченные длины С-С-связей. Эти особенности строения приводят к определенной деформации молекулы. Связи в циклопропане называют изогнутыми или «банановыми», по своему характеру они являются промежуточными между σ - и π -связями, поэтому циклопропаны в некоторых отношениях ведут себя подобно соединениям с двойной связью. Такое искажение приводит к тому, что угол в циклопропане оказывается не 60º, а 106º и угол Н-С-Н – 120º. В циклобутане «байеровское напряжение» по сравнению с циклопропаном меньше, поскольку соседние атомы углерода образуют между собой угол 90º. Более того, это напряжение частично компенсируется путем деформации кольца за счет выхода его из плоскости и существования в виде равновесных структур:
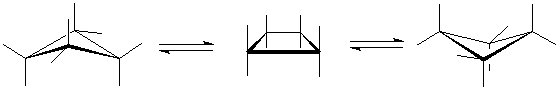
Напряжение молекулы, выводящее один из атомов из плоскости цикла, называется торсионным (поворачивающим). В отличие от циклопропана и циклобутана в циклопентане угловые искажения незначительны, однако сохраняется взаимное отталкивание пяти пар атомов водорода и коволентных электронов, находящихся в заслоненном положении, что и приводит к выходу одного из атомов углерода из плоскости кольца и существованию структуры в состоянии псевдовращения, т.е. быстрому поочередному переходу углеродных атомов из плоскости в форму конверта и полукресла; которая пробегает по циклу как волна.
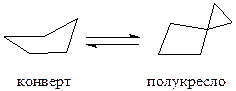
Для компенсации углового напряжения циклогексан может принять две конформации - ванны (или лодки) и кресла. Следует отметить, что предпочтительность формы кресла следует из общих конформационных соображений, а энергетически она устойчивее на 24-28 кДж/моль.
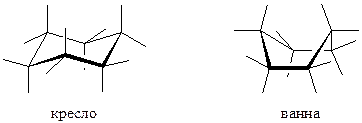
Если мысленно привести во вращение структуру циклогексана, то можно наблюдать два типа С-Н-связей: 6 связей, расположенных параллельно оси вращения будут называться аксиальными, а 6 связей расположенных почти перпендикулярно оси, т.е. по экватору, соответственно, экваториальными. На самом деле, так же, как и в циклопентане происходит волнообразное по-очередное изменение по кольцу положения атомов углерода по равновесной схеме

Взаимное превращение двух форм кресла известно как инверсия конформации. При охлаждении циклогексана скорость конверсии кресло-кресло замедляется и при низких температурах (<-100ºС) становится возможным идентифицировать в спектре ЯМР 1Н два набора сигналов, отвечающих аксиальным и экваториальным атомам водорода.
В отличие от малых и обычных циклов причиной напряжения в средних циклах является «внутримолекулярная теснота». Для понимания этого рассмотрим особенности строения средних циклов на примере циклодекана. В циклодекане 14 связей ориентированы вовне и называются экстрааннулярными и 6 связей направлены внутрь кольца – это интраннулярные связи.
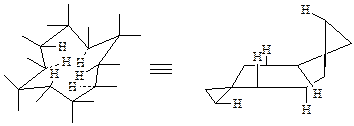
Именно интраннулярные связи и создают «внутримолекулярную тесноту», создающую трансаннулярное взаимодействие, обусловливающее напряжение в циклах среднего размера. Заместители, более крупные, чем атомы водорода не могут занимать интранулярных положений и являются причиной конформационных изменений молекулы.
Алициклические соединения с числом звеньев больше 12 обладают большой конформационной подвижностью и поэтому определенные конформации в этом случае трудно зафиксировать. Высшие гомологи приближаются к алканам и имеют совершенно ненапряженные формы.
Способы получения
Одним из наиболее ранних методов синтеза алициклических соединений является внутримолекулярный вариант реакции Вюрца

Дегалогенирование протекает с лучшим выходом при применении цинковой пыли в спиртовом растворе. Этот тип 1,3-элиминирования нашел широкое распространение в синтезе некоторых высоко напряженных циклопропанов

Присоединение карбенов и карбеноидов к олефинам является общим путем синтеза циклопропанов. Циклопропанирование под действием иодистого метилена и цинк-медной пары носит название реакции Симмонса - Смита

Диазосоединения так же при взаимодействии с олефинами в присутствии катализаторов дают циклопропаны через стадию образования промежуточного гетероциклического интермедиата

Циклические гидразоны, являющиеся диазоаналогами отмеченных интермедиатов, при нагревании в присутствии катализатора разлагаются с образованием циклопропанов и циклобутанов в зависимости от размера цикла

Среди других реакций, имеющих общее синтетическое значение, следует отметить реакцию [2+2]-циклоприсоединения, которая приводит к циклобутанам. Известны как термический, так и фотохимический пути. При нагревании алленов происходит их димеризация с образованием четырех членного цикла

УФ-облучение 1,3-диенов или смеси простых и сопряженных олефинов также приводит к образованию циклобутанов

Реакцией по Перкину взаимодействием α, ω -дигалоидалканов (префикс «α, ω -» применяется для обозначения функциональных групп на концах цепи) с натриймалоновым эфиром получают диэтоксикарбонильное производное циклобутана

Химические свойства
Многие из реакций алифатических соединений, рассмотренных выше, применимы также для алициклических соединений. Подобно им циклоалканы вступают в реакцию ионного и свободно-радикального галогенирования, окисления и нитрования без изменения скелета или разрыва углерод-углеродной связи. Различия в химическом поведении часто обусловлены наличием в некоторых циклических структурах избыточного углового напряжения.
Напряженность молекулы циклопропана, как уже отмечалось, приводит к тому, что С-С-связи занимают в нем промежуточное положение между обычными σ - и π -связями. В этом состоит особенность химического поведения циклопропана и циклобутана. Так, они гидрируются на никеле Ренея с разрывом С-С-связи, причем, если в циклопропане это происходит при 80ºС, то в циклобутане – только при 120ºС.

Раскрытие кольца циклопропана и циклобутана происходит также в некоторых реакциях присоединения. Так, при действии брома, бромистого водорода и серной кислоты циклопропан дает соответственно 1,3–дибромпропан, н -пропилбромид и н -пропилсульфат; циклобутан в этих реакциях менее активен

При действии хлора наряду с образованием ациклического дихлорида протекает реакция металепсии с замещением водородов и сохранением цикла

Электроноакцепторные заместители в кольце стабилизирует его, а электронодонорные, наоборот, облегчают раскрытие цикла.
Многие реакции циклопропанового кольца говорят о его аналогии с двойной связью. Так, электроноакцепторные заместители направляют реакцию гидробромирования против правила Марковникова

Аналогично α, β -ненасыщенным сопряженным системам они вступают в реакции 1,4–сопряженного присоединения. А алкилзамещенные циклопропаны легко присоединяют ацетат ртути

Хлористый водород присоединяется к сабинену по крайним атомам сопряженной системы циклопропан – двойная связь
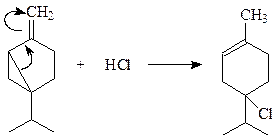
Сопряжение циклопропана с двойной связью фиксируется и в ИК- и УФ-спектрах.
Циклопропан – газ, анестетик общего действия, применяется при хирургических операциях, не вызывает нежелательных последствий для организма.
Следует отметить, что непредельные трех- и четырехчленные циклы неустойчивы, поэтому имеют крайне ограниченное применение в органической химии.
Кислородсодержащие производные
Циклопропанон существует в неустойчивой гидратированной форме, легко изомеризующейся в пропионовую кислоту. Он получен взаимодействием кетена, диазометана и воды

В отсутствии воды эта реакция приводит через стадию взаимодействия промежуточного циклопропанона со второй молекулой диазометана к циклобутанону
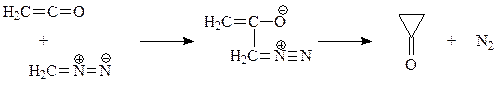
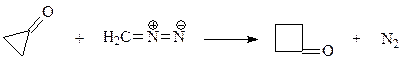
Циклобутандион-1,3 получен взаимодействием этинилэтилового эфира с кетеном

Циклобутандион-1,3 представляет собой бесцветные пластинки с температурой плавления 119-120ºС. Как и все 1,3-дикетоны он заметно енолизирован.
Карбоновые кислоты циклопропанового и циклобутанового ряда являются более стабильными соединениями. Синтез эфира циклобутан-1,1-дикарбоновой кислоты по Перкину приведен выше. Димеризацией α, β -непредельных кислот получаются циклобутан-1,3-дикарбоновые кислоты

Для получения циклопропанкарбоновых кислот широко используется реакция непредельных кислот с диазосоединениями

Циклопропанкарбоновая кислота может быть получена из нитрила γ -броммасляной кислоты

Из карбоновых кислот могут быть получены другие функциональные производные циклоалканов.
Среди природных соединений, содержащих фрагмент циклопропанкарбоновой кислоты можно отметить транс -хризантемовую кислоту, эфиры которой образуют класс пиретроидов-инсектицидов малоопасных для теплокровных.






