Спирты. Спиртами называют соединения, содержащие одну или несколько гидроксильных групп, непосредственно связанных с углеводородным радикалом.
В зависимости от характера углеводородного радикала спирты делятся на алифатические, алициклические и ароматические, причем у последних гидроксильная группа не связана с атомом углерода бензольного кольца. Спирты, у которых гидроксильная группа связана с ароматическим кольцом, называются фенолами.
В зависимости от числа гидроксильных групп спирты подразделяют на одно-, двух- и трехатомные. Двухатомные спирты часто называют гликолями. Спирты, содержащие несколько групп —ОН, объединяют общим названием многоатомные спирты.
В зависимости от того, при каком углеродном атоме находится гидроксильная группа, различают спирты первичные (RСН2ОН), вторичные (R2СНОН) и третичные (R3СОН).
Спирты
Структурная изомерия предельных спиртов определяется строением углеродной цепи и положением гидроксильной группы в цепи. Изомерия двух и трехатомных спиртов, кроме того, определяется взаимным расположением гидроксильных групп.
По систематической номенклатуре названия спиртов образуют, добавляя суффикс -ол к названию углеводорода с самой длинной углеродной цепью, включающей гидроксильную группу. Нумерацию цепи начинают с того края, ближе к которому расположена гидроксильная группа.
Физические свойства спиртов зависят от строения углеводородного радикала, количества гидроксильных групп и их положения. Первые представители гомологического ряда спиртов — жидкости, высшие — твердые вещества. Метанол и этанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в воде падает. Высшие спирты практически нерастворимы в воде. Спирты обладают аномально высокими температурами кипения по сравнению с углеводородами, что объясняется сильной ассоциацией молекул спирта в жидком состоянии за счет образования достаточно прочных водородных связей:
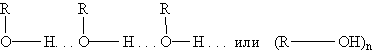
Этим объясняется то, что уже первые члены гомологического ряда спиртов — жидкости, которые имеют сравнительно высокие температуры кипения. Образованием водородных связей между молекулами спирта и воды объясняется их хорошая растворимость в воде. Уменьшение же растворимости у последующих членов гомологического ряда вызывается увеличением числа атомов углерода в углеводородном радикале. Водородные связи — непрочные (17-22 кДж/моль) и при испарении спиртов легко разрываются.
Химические свойства спиртов обусловлены наличием в их молекулах полярных ковалентных связей С—О и О—Н. Спирты вступают в химические реакции с разрывом одной из этих связей. Так как обе связи полярны, то их разрыв происходит по ионному (гетеролитическому) механизму с образованием органических анионов или катионов:
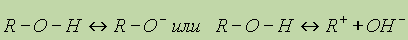
Диссоциация спиртов на ионы происходит в незначительной степени, поэтому спирты дают нейтральную реакцию — в их присутствии не изменяется окраска лакмуса или фенолфталеина.
Способы получения. 1. Получение из алкенов. Гидратация алкенов протекает по механизму электрофильного присоединения по правилу Марковникова. Это один из наиболее важных промышленных способов получения спиртов.
2. Получение из галогенопроизводных. Галогеналканы гидролизуются под действием водных растворов щелочей. Реакция протекает по механизму нуклеофильного замещения:
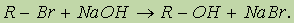
3. Восстановление карбонильных соединений. При восстановлении альдегидов образуются первичные спирты, при восстановлении кетонов — вторичные:
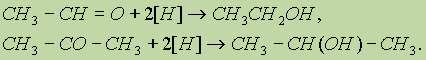
5. Действие реактивов Гринъяра на карбонильные соединения.
Химические свойства. Различают два основных типа реакций спиртов с участием функциональной группы —ОН:
1. реакции с разрывом связи О—Н:
а) взаимодействие спиртов с щелочными и щелочноземельными металлами с образованием алкоксидов;
б) реакция спиртов с органическими и минеральными кислотами с образованием сложных эфиров;
в) окисление спиртов под действием дихромата или перманганата калия до карбонильных соединений. Скорость реакций, при которых разрывается связь О—Н, уменьшается в ряду:
первичные спирты > вторичные > третичные.
2. Реакции, сопровождающиеся разрывом связи С—О:
а) каталитическая дегидратация с образованием алкенов (внутримолекулярная дегидратация) или простых эфиров (межмолекулярная дегидратация);
б) замещение группы —ОН галогеном, например при действии галогеноводородов с образованием алкилгалогенидов.
Скорость реакций, при которых разрывается связь С—О, уменьшается в ряду:
третичные спирты > вторичные > первичные.
Спирты являются амфотерными соединениями.
1. Кислотные свойства спиртов выражены очень слабо. Низшие спирты бурно реагируют с щелочными металлами:
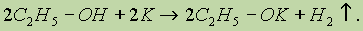
С увеличением длины углеводородного радикала скорость этой реакции замедляется.
В присутствии следов влаги образующиеся алкоголяты разлагаются до исходных спиртов:
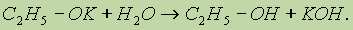
Это доказывает, что спирты — более слабые кислоты, чем вода.
2. Слабые основные свойства спиртов обусловлены наличием неподеленной электронной пары на атоме кислорода и проявляются в обратимых реакциях с галогеноводородами:


Положение равновесия зависит от соотношения реагентов.
3. Образование сложных эфиров протекает по механизму нуклеофильного присоединения-отщепления:

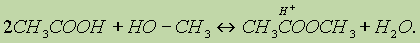
В качестве нуклеофила выступает молекула спирта, атакующая атом углерода карбоксильной группы, несущий частичный положительный заряд. Отличительной особенностью этой реакции является то, что замещение протекает у атома углерода, находящегося в состоянии sp2-гибридизации.
4. Межмолекулярная дегидратация спиртов. При нагревании спирта в присутствии каталитических количеств сильной кислоты происходит отщепление молекулы воды от двух молекул спирта и образуется простой эфир:
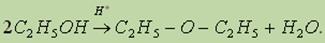
Простые эфиры — это органические вещества, молекулы которых состоят из углеводородных радикалов, соединенных атомом кислорода: R'—О—R", где R' и R" — радикалы, которые могут быть различными или одинаковыми.
Диэтиловый, или серный, эфир — хороший растворитель многих органических веществ, применяется для чистки тканей, а в медицине — при хирургических операциях, так как обладает анестезирующим действием.
5. Реакция элиминирования, или внутримолекулярной дегидратации (см. “Алкены”). Конкурентная реакции 4) (см. предыдущую реакцию), реакция 5) становится преобладающей при использовании больших количеств кислоты:
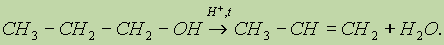
6. Реакции окисления. Первичные спирты окисляются в альдегиды, которые, в свою очередь, могут окисляться в карбоновые кислоты:
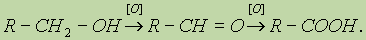
Вторичные спирты окисляются в кетоны:

Третичные спирты более устойчивы к окислению. При действии на них сильных окислителей может происходить расщепление углеродного скелета молекулы третичного спирта с образованием карбоновых кислот и кетонов с меньшим числом углеродных атомов, чем в молекуле исходного третичного спирта. Окисление обычно проводят дихроматом или перманганатом калия с серной кислотой.
Многоатомные спирты. Двух- и трехатомные спирты получают теми же способами, что и одноатомные. В качестве исходных соединений могут быть использованы алкены, галогенопроизводные и другие соединения.
Общим методом синтеза гликолей является окисление алкенов перманганатом калия в нейтральной или щелочной среде.
Для двух- и трехатомных спиртов характерны основные реакции одноатомных спиртов. Однако в их химических свойствах есть особенности, обусловленные присутствием в молекуле двух и более гидроксильных групп.
Кислотность многоатомных спиртов выше, чем одноатомных, что объясняется наличием в молекуле дополнительных гидроксильных групп, обладающих отрицательным индуктивным эффектом. Поэтому многоатомные спирты, в отличие от одноатомных, реагируют с щелочами, образуя соли. По аналогии с алкоголятами соли двухатомных спиртов называют гликолятами, а трехатомных — глицератами.
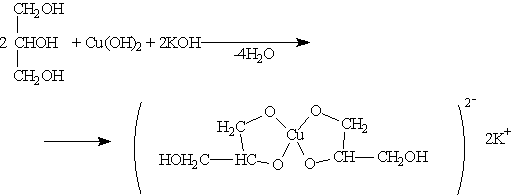
При взаимодействии гидроксида меди (II) с глицерином и другими многоатомными спиртами происходит растворение гидроксида и образуется комплексное соединение синего цвета. Эта реакция используется для обнаружения многоатомных спиртов, имеющих гидроксильные группы при соседних атомах углерода —СН(ОН)—СН(ОН)—:
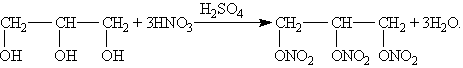
Для многоатомных спиртов характерно образование сложных эфиров. В частности, при реакции глицерина с азотной кислотой в присутствии каталитических количеств серной кислоты образуется тринитрат глицерина (нитроглицерин):
Фенолы. Названия фенолов составляют с учетом того, что для родоначальной структуры по правилам ИЮПАК сохранено тривиальное название “фенол”. Нумерацию атомов углерода бензольного кольца начинают от атома, непосредственно связанного с гидроксильной группой (если она является старшей функцией), и продолжают в такой последовательности, чтобы имеющиеся заместители получили наименьшие номера.
Монозамещенные производные фенола, например метилфенол (крезол), могут существовать в виде трех структурных изомеров — орто-, мета- и пара-крезолов.
Физические свойства. Фенолы в большинстве своем — кристаллические вещества (мета-крезол — жидкость) при комнатной температуре. Они обладают характерным запахом, довольно плохо растворимы в воде, но хорошо растворяются в водных растворах щелочей. Фенолы образуют прочные водородные связи и имеют довольно высокие температуры кипения.
Способы получения.
1. Получение из галогенбензолов. При нагревании хлорбензола и гидроксида натрия под давлением получают фенолят натрия, при дальнейшей обработке которого кислотой образуется фенол:
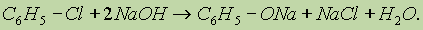
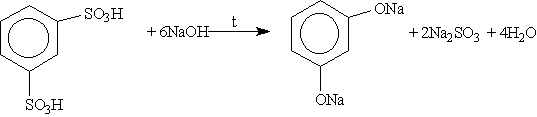
2. Получение из ароматических сульфокислот (см. реакцию 3 в разделе “Химические свойства бензола”), реакция проводится при сплавлении сульфокислот со щелочами. Первоначально образующиеся феноксиды обрабатывают сильными кислотами для получения свободных фенолов. Метод обычно применяют для получения многоатомных фенолов:
Химические свойства. В фенолах р-орбиталь атома кислорода образует с ароматическим кольцом единую -систему. Вследствие такого взаимодействия электронная плотность у атома кислорода уменьшается, а в бензольном кольце повышается. Полярность связи О—Н увеличивается, и водород ОН-группы становится более реакционноспособным и легко замещается на металл даже при действии щелочей (в отличие от предельных одноатомных спиртов).
Кроме того, в результате такого взаимного влияния в молекуле фенола увеличивается реакционная способность бензольного кольца в орто- и пара-положениях в реакциях электрофильного замещения (галогенирования, нитрования, поликонденсапии и т. д.):
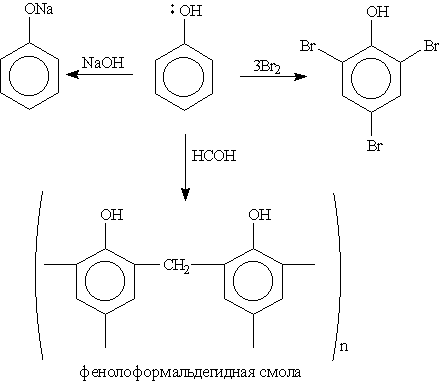
1. Кислотные свойства фенола проявляются в реакциях со щелочами (сохранилось старинное название “карболовая кислота”):
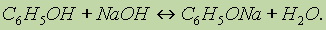
Фенол, однако, является очень слабой кислотой. При пропускании через раствор фенолятов углекислого или сернистого газов выделяется фенол — такая реакция доказывает, что фенол — более слабая кислота, чем угольная и сернистая:

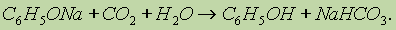
Кислотные свойства фенолов ослабляются при введении в кольцо заместителей I рода и усиливаются при введении заместителей II рода.
2. Образование сложных эфиров. В отличие от спиртов фонолы не образуют сложных эфиров при действии на них карбоновых кислот; для этого используются хлорангидриды кислот:
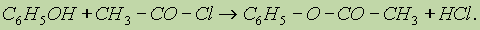
3. Галогенирование. При действии на фенол бромной воды образуется осадок 2,4,6-трибромфенола:
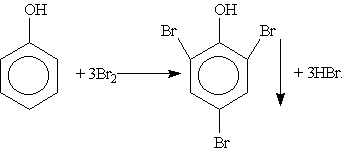
Это — качественная реакция для обнаружения фенола.
4. Нитрование. Под действием 20% -ной азотной кислоты фенол легко превращается в смесь орто- и пара-нитрофенолов. Если нитровать фенол концентрированной азотной кислотой, то образуется 2,4,6-тринитрофенол — сильная кислота (пикриновая).
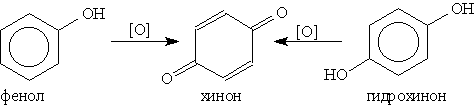
5. Окисление. Фенолы легко окисляются даже под действием кислорода воздуха. Так, при стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет. При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона образуется хинон:
Альдегиды, кетоны
Органические соединения, в молекуле которых имеется карбонильная группа >С=O, называются карбонильными соединениями, или оксосоединениями. Карбонильные соединения делятся на две большие группы — альдегиды и кетоны.
Альдегиды содержат в молекуле карбонильную группу, связанную с атомом водорода, т. е. альдегидную группу —СН=O. Кетоны содержат карбонильную группу, связанную с двумя углеводородными радикалами, т. е. кетонную группу.
В зависимости от строения углеводородных радикалов альдегиды и кетоны бывают алифатическими, алициклическими и ароматическими.
Изомерия альдегидов связана только со строением радикалов.
Для альдегидов часто используют тривиальные названия, соответствующие названиям кислот (с тем же числом углеродных атомов), в которые альдегиды переходят при окислении. По систематической номенклатуре названия альдегидов образуют, прибавляя окончание -аль к названию родоначального углеводорода с самой длинной углеродной цепью, включающей карбонильную группу, от которой и начинают нумерацию цепи. Названия ароматических альдегидов производят от родоначальной структуры ряда — бензальдегида С6Н5 —СН=О.
Изомерия кетонов связана со строением радикалов и с положением карбонильной группы в углеродной цепи.
Кетоны часто называют по наименованию радикалов, связанных с карбонильной группой, или по систематической номенклатуре: к названию предельного углеводорода добавляют суффикс -он и указывают номер атома углерода, связанного с карбонильным кислородом. Нумерацию начинают с ближайшего к кетонной группе конца цепи.
В молекуле кетона радикалы могут быть одинаковыми или разными. Поэтому кетоны, как и простые эфиры, делятся на симметричные и смешанные.
Способы получения. Исходными соединениями для получения альдегидов и кетонов могут быть углеводороды, галогенопроизводные, спирты или кислоты.
1. Гидратация алкинов. Взаимодействие алкинов с водой происходит в присутствии солей Нg2+ и дает ацетальдегид СН3СНО в случае ацетилена и различные кетоны в случае гомологов ацетилена (см. “Алкины”).
2. Окисление спиртов. При окислении первичных спиртов образуются альдегиды, вторичных — кетоны (см. “Спирты”).
3. Важным промышленным способом получения формальдегида (метаналя) является каталитическое окисление метана кислородом воздуха (см. “Алканы”).
Физические свойства. Оксосоединения не способны образовывать водородные связи, поэтому их температуры кипения значительно ниже, чем соответствующих спиртов. Температуры кипения кетонов обычно бывают несколько выше, чем изомерных им альдегидов.
В обычных условиях только формальдегид является газом. Остальные оксосоединения — жидкости или твердые вещества. Формальдегид Н2СО имеет резкий неприятный запах. Средние гомологи ряда альдегидов обладают устойчивым характерным запахом (альдегидный запах). Высшие альдегиды (С7—С16) обладают приятным запахом и широко используются в парфюмерии.
Формальдегид хорошо растворим в воде, его 40%-ный водный раствор называют формалином. Ацеталъдегид (этаналь) СНзСНО также хорошо растворим в воде.
Ацетон (пропанон, или диметилкетон) — бесцветная жидкость, хорошо растворимая в воде, спирте и эфире. Это широко используемый органический растворитель, он хорошо растворяет жиры, смолы и многие другие органические вещества.
Химические свойства. Химические свойства альдегидов и кетонов обусловлены присутствием в их молекуле активной карбонильной группы, в которой двойная связь сильно поляризована в силу большой электроотрицательности кислорода (>С==О).
В результате на карбонильном атоме углерода (карбанион) возникает заметный положительный заряд. Поэтому для альдегидов и кетонов характерны реакции присоединения по двойной связи С=О. Большинство из них протекает как нуклеофильное присоединение.
Кроме реакции присоединения по карбонильной группе, для альдегидов характерны также реакции с участием -атомов водорода, соседних с карбонильной группой. Их реакционная способность связана с электроноакцепторным влиянием карбонильной группы, которое проявляется в повышенной полярности связи С—Н. Это приводит к тому, что альдегиды, в отличие от кетонов, легко окисляются. Их взаимодействие с аммиачным раствором оксида серебра является качественной реакцией на альдегиды.
Реакции нуклеофильного присоединения. Альдегиды и кетоны, обладая электрофильным центром, способны вступать во взаимодействие с нуклеофильными реагентами. Для оксосоединений наиболее характерны реакции, протекающие по механизму нуклеофильного присоединения обозначаемому АN (от англ. addition nucleophilic).
1. Реакция с циановодорооной (синильной) кислотой. Реакция имеет важное значение в органической химии. Во-первых, в результате реакции можно удлинить углеродную цепь; во-вторых, продукты реакции — гидроксинитрилы — служат исходными соединениями для синтеза гидроксикарбоновых кислот:
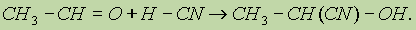
2. Взаимодействие со спиртами. Альдегиды могут взаимодействовать с одной или двумя молекулами спирта, образуя соответственно полуацетали и ацетали.
Полуацеталями называются соединения, содержащие при одном атоме углерода гидроксильную и алкоксильную группы. Ацетали — это соединения, содержащие при одном атоме углерода две алкоксильные группы:
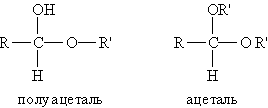
Реакцию получения ацеталей широко используют в органических синтезах для “защиты” активной альдегидной группы от нежелательных реакций:
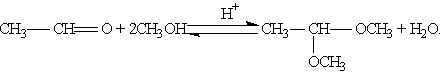
Особенно важное значение подобные реакции имеют в химии углеводов.
3. Присоединение гидросульфитов служит для выделения альдегидов из смесей с другими веществами и для получения их в чистом виде, поскольку полученное сульфопроизводное очень легко гидролизуется:
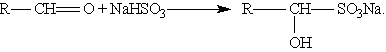
4. Присоединение реактива Гриньяра. В органическом синтезе чрезвычайно часто используется реактив Гриньяра — одно из простейших металлоорганических соединений.
При добавлении раствора галогеналкана в диэтиловом эфире к магниевой стружке легко происходит экзотермическая реакция, магний переходит в раствор и образуется реактив Гриньяра:

где R — алкильный или арильный радикал, Х — галоген.
а) Взаимодействием реактива Гриньяра с формальдегидом можно получить практически любой первичный спирт (кроме метанола). Для этого продукт присоединения реактива Гриньяра гидролизуют водой:
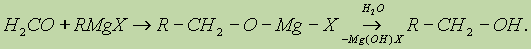
б) При использовании любых других алифатических альдегидов могут быть получены вторичные спирты:
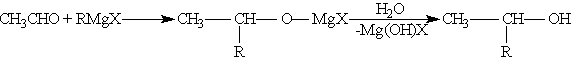
в) Взаимодействием реактивов Гриньяра с кетонами получают третичные спирты:
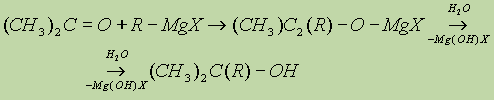
5. Восстановление оксосоединений (см. “Спирты”).
6. Реакции окисления. Альдегиды и кетоны по-разному относятся к действию окислителей. Альдегиды легко (значительно легче, чем спирты) окисляются в соответствующие карбоновые кислоты. Для их окисления можно использовать такие мягкие окислители, как оксид серебра и гидроксид меди (II).
Кетоны к действию окислителей инертны, в частности они не окисляются кислородом воздуха. Кетоны реагируют только с очень сильными окислителями, способными разорвать углерод-углеродные связи в их молекуле.
а) Одной из качественных реакций для обнаружения альдегидной группы является реакция “серебряного зеркала” — окисление альдегидов оксидом серебра.
Оксид серебра всегда готовят непосредственно перед опытом, добавляя к раствору нитрата серебра раствор гидроксида аммония:
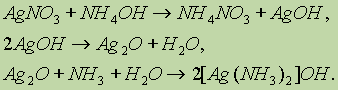
В растворе аммиака оксид серебра образует комплексное соединение, при действии которого на альдегид происходит окислительно-восстановительная реакция. Альдегид окисляется в соответствующую кислоту (точнее, в ее аммонийную соль), а комплексный катион восстанавливается до металлического серебра, которое дает блестящий налет на стенках пробирки — “серебряное зеркало”:
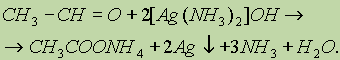
б) Другая качественная реакция на альдегиды заключается в окислении их гидроксидом меди (II). При окислении альдегида светло-голубой гидроксид меди (II) превращается в желтый гидроксид меди (I) при комнатной температуре. Если подогреть раствор, то гидроксид меди (I) превращается в оксид меди (I) красного цвета, который плохо растворим в воде и выпадает в осадок:
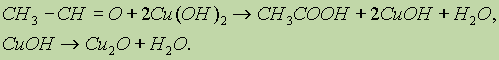
7. Реакции поликонденсации — (см. схему реакции фенола с формальдегидом в “Спирты, фенолы”).
Поликонденсация — это процесс образования высокомолекулярных соединений из низкомолекулярных, сопровождающийся выделением побочного вещества (воды, аммиака, хлороводорода и др.).
При полимеризации в отличие от поликонденсации выделения побочных веществ не происходит. Продукты поликонденсации (исключая побочные вещества) так же, как и продукты полимеризации, называются полимерами.
В результате поликонденсации фенола с формальдегидом в присутствии катализаторов образуются фенолоформальдегидные смолы, из которых получают пластмассы — фенопласты (бакелиты). Фенопласты —важнейшие заменители цветных и черных металлов во многих отраслях промышленности. Из них изготовляются большое количество изделий широкого потребления, электроизоляционные материалы и строительные детали.
Органические кислоты
Карбоновые кислоты. Карбоновыми кислотами называются соединения, содержащие карбоксильную группу
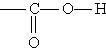
Классификация. По числу карбоксильных групп карбоновые кислоты делят на монокарбоновые, или одноосновные (одна группа —СООН), дикарбоновые, или двухосновные (две группы —СООН), и т. д. В зависимости от строения углеводородного радикала, с которым связана карбоксильная группа, карбоновые кислоты бывают алифатическими (например, уксусная или акриловая), алициклическими (например, циклогексанкарбоновая) или ароматическими (бензойная, фталевая).
Если в углеводородном радикале карбоновых кислот атом (атомы) водорода замещен на другие функциональные группы, то такие кислоты называются гетерофункциональными. Среди них различают галогенкарбоновые (например, CH2Cl—СООН), нитрокислоты (например, NО2—С6Н4СООН), аминокислоты (см. “Азотсодержащие соединения”), оксикислоты (например, СН3—СН(ОН)—СООН) и др.
Карбоновые кислоты с числом атомов углерода выше 6 называют высшими (жирными) кислотами.
Номенклатура. В основе названий карбоновых кислот лежат названия соответствующих углеводородов. Наличие карбоксильной группы отражается окончанием -овая. Карбоновые кислоты часто имеют тривиальные названия: муравьиная, уксусная и др. (см. табл.).
Карбоновые кислоты
| Формула | Систематическое название | Тривиальное название |
| Монокарбоновые кислоты | ||
| НСООН | Метановая | Муравьиная |
| СН 3СООН | Этановая | Уксусная |
| C2H5COOH | Пропановая | Пропионовая |
| C6H5COOH | Бензойная | |
| СН3(СН2)16СООН | Октадециловая | Стеариновая |
| CH2==CH—СООН | Пропеновая | Акриловая |
| Дикарбоновые кислоты | ||
| НООС—СООН | Этандиовая | Щавелевая |
| НООС—CH2—СООН | Пропандиовая | Малоновая |
| НООС—СН2—CH2—СООН | Бутандиовая | Янтарная |
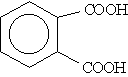
| Бензол-1,2-дикарбоновая | Фталевая |
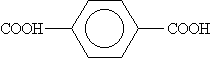
| Бензол-1,4-дикарбоновая | Терефталевая |
Названия ароматических кислот производят от бензойной кислоты, например:
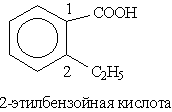
Изомерия. Возможны следующие виды изомерии:
1. Изомерия углеродной цепи. Она начинается с бутановой кислоты (С3Н7СООН), которая существует в виде двух изомеров: масляной и изомасляной (2-метилпропановой) кислот.
2. Изомерия положения кратной связи, например:
СН2==СН—СН2—СООН СН3—СН==СН—СООН
Бутен-3-овая кислота Бутен-2-овая кислота
(винилуксусная кислота) (кротоновая кислота)
3. Цис-, транс-изомерия, например:
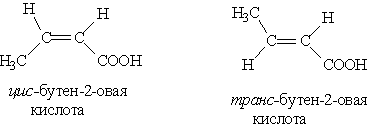
4. Межклассовая изомерия: например, масляной кислоте (СН3—СН2—CH2—СООН) изомерны метиловый эфир пропановой кислоты (СН3—СН2—СО—О—СНз) и этиловый эфир уксусной кислоты (СН3—СО—О —CH2—СН3).
5. У гетерофункционалъных кислот возможна изомерия, связанная с положением функциональных групп, например, существуют три изомера хлормасляной кислоты: 2-хлорбутановая, 3-хлорбутановая и 4-хлорбутановая.
Для гетерофункциональных кислот возможна также оптическая изомерия.
Способы получения. 1. Окисление альдегидов и первичных спиртов — общий способ получения карбоновых кислот:
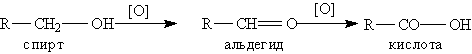
2. Другой общий способ — гидролиз галогензамещенных углеводородов, содержащих три атома галогена у одного атома углерода:
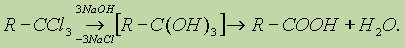
3. Взаимодействие реактива Гриньяра с СО2:
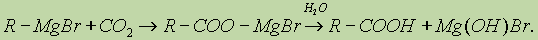
4. Гидролиз сложных эфиров:
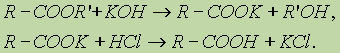
5. Гидролиз ангидридов кислот:
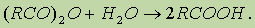
6. Для отдельных кислот существуют специфические способы получения:
Муравьиную кислоту получают нагреванием оксида углерода (II) с порошкообразным гидроксидом натрия под давлением и обработкой полученного формиата натрия сильной кислотой:
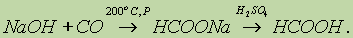
Уксусную кислоту получают в промышленных масштабах каталитическим окислением бутана кислородом воздуха:
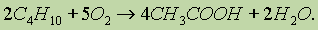
Для получения бензойной кислоты можно использовать окисление монозамещенных гомологов бензола кислым раствором перманганата калия (см. “Ароматические углеводороды”):
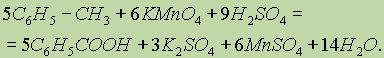
Физические свойства. Насыщенные алифатические монокарбоновые кислоты образуют гомологический ряд, который характеризуется общей формулой СnН2n+1СООН. Низшие члены этого ряда (С1— С9) представляют собой жидкости, обладающие характерным острым запахом. Средние представители ряда—вязкие, “маслообразные” жидкости; начиная с С10 — твердые вещества.
Кислоты, содержащие 1—3 углеродных атома, неограниченно смешиваются с водой. С дальнейшим ростом углеводородного радикала растворимость монокарбоновых кислот уменьшается, твердые высшие жирные кислоты в воде не растворяются.
Ненасыщенные кислоты, как правило, жидкости.
Все дикарбоновые и ароматические кислоты при комнатной температуре — кристаллические вещества.
Строение. Карбоксильная группа СООН состоит из карбонильной группы С==O и гидроксильной группы ОН, которые оказывают взаимное влияние друг на друга. В группе СО атом углерода несет частичный положительный заряд и притягивает к себе неподеленную электронную пару атома кислорода в группе ОН. При этом электронная плотность на атоме кислорода уменьшается и связь O-Н ослабляется (увеличиваются кислотные свойства):
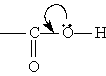
В свою очередь, группа ОН “гасит” положительный заряд на группе СО, которая из-за этого теряет способность к реакциям присоединения, характерным для карбонильных соединений.
Химические свойства. 1. Диссоциация кислот. В водном растворе карбоновые кислоты диссоциируют:
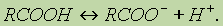
Однако это равновесие диссоциации сильно сдвинуто влево, поэтому карбоновые кислоты, как правило, слабые кислоты.
Вследствие взаимного влияния атомов в молекулах дикарбоновых кислот они являются более сильными, чем одноосновные.
2. Образование солей. Карбоновые кислоты обладают всеми свойствами обычных кислот: реагируют с активными металлами, основными оксидами, основаниями:
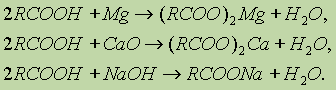
Карбоновые кислоты — слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей.
3. Образование функциональных производных. При замещении группы ОН в карбоновых кислотах различными группами (X) образуются функциональные производные кислот, имеющие общую формулу R—СО—X; здесь R означает алкильную либо арильную группу.
Хлорангидриды получают действием хлорида фосфора (V) на кислоты:
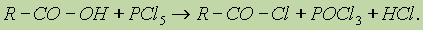
Сложные эфиры образуются при нагревании кислоты со спиртом в присутствии серной кислоты (обратимая реакция этерификации):
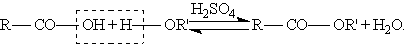
Механизм реакции этерификации был установлен методом “меченых атомов”.
Сложные эфиры можно также получить при взаимодействии хлорангидридов кислот и алкоголятов щелочных металлов:
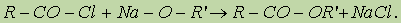
Реакции хлорангидридов карбоновых кислот с аммиаком приводят к образованию амидов:
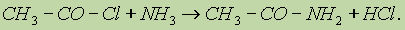
Амидами карбоновых кислот называются производные этих кислот, в которых гидроксилъная группа замещена на аминогруппу.
Например:
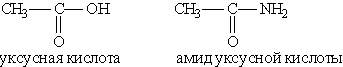
Общая формула амидов RCONH2. Функциональная группа СONH2 называется амидогруппой.
Названия амидов производят от названий кислот, из которых они образовались, с добавлением слова амид.
Физические свойства амидов. Амид муравьиной кислоты — жидкость, амиды всех других кислот — белые кристаллические вещества. Низшие амиды хорошо растворимы в воде. Водные растворы амидов дают нейтральную реакцию на лакмус.
Важнейшее свойство амидов — способность их к гидролизу в присутствии кислот и щелочей. При этом образуются кислота и аммиак:
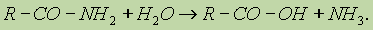
К амидам кислот относится мочевина. Это конечный продукт азотистого обмена в организме человека и животных. Образуется при распаде белков и выделяется вместе с мочой. Мочевину можно рассматривать как полный амид угольной кислоты:

Мочевина, или карбамид, — белое кристаллическое вещество, хорошо растворимое в воде. Впервые была получена немецким ученым Велером в 1828 г. из цианата аммония:
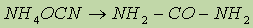
Это первое органическое соединение, полученное синтетическим путем. В промышленности мочевину получают из оксида углерода (IV) и аммиака при нагревании (150° С) и высоком давлении:
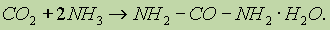
С сильными минеральными кислотами мочевина образует соли:
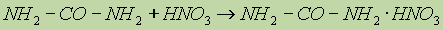
Мочевина — ценное высококонцентрированное азотное удобрение (46,6% азота), широко используется на всех почвах и под все культуры. Как источник азота, ее добавляют в корм скоту. Применяется также как исходное вещество для получения мочевиноформальдегидных смол и лекарственных веществ (люминала, веронала и др.).
4. Ряд свойств карбоновых кислот обусловлен наличием углеводородного радикала. Так, при действии галогенов на свету образуются -галогензамещенные кислоты:
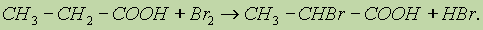
Непредельные карбоновые кислоты способны к реакциям присоединения.
5. Окислительно-восстановительные реакции карбоновых кислот.
Карбоновые кислоты при действии восстановителей способны превращаться в альдегиды или спирты:
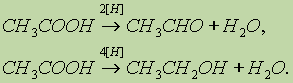
Насыщенные карбоновые кислоты устойчивы к действию концентрированных серной и азотной кислот. Исключение составляет муравьиная кислота:
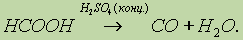
Муравьиная кислота НСООН отличается рядом особенностей, поскольку в ее составе есть альдегидная группа:
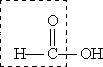
Муравьиная кислота — сильный восстановитель и легко окисляется до СО2. Она дает реакцию “серебряного зеркала”:
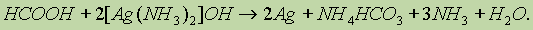
Кроме того, муравьиная кислота окисляется хлором:
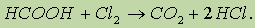
Сложные эфиры. Среди функциональных производных кислот особое место занимают сложные эфиры — производные кислот, у которых атом водорода в карбоксильной группе заменен углеводородным радикалом. Общая формула сложных эфиров
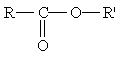
где R и R' — углеводородные радикалы (в сложных эфиpax муравьиной кислоты R — атом водорода).
Номенклатура и изомерия. Названия сложных эфиров производят от названия углеводородного радикала и названия кислоты, в котором вместо окончания -овая используют суффикс -am, например:
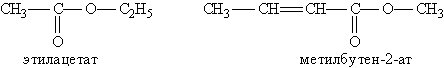
Для сложных эфиров характерны три вида изомерии:
1. Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку — с пропилового спирта, например, этилбутирату изомерны этилизобутират, пропилацетат и изопропилацетат.
2. Изомерия положения сложноэфирной группировки —СО—О—. Этот вид изомерии начинается со сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например этилацетат и метилпропионат.
3. Межклассовая изомерия, например, метилацетату изомерна пропановая кислота.
Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи и цис-, транс-изомерия.
Физические свойства сложных эфиров. Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие, нерастворимые в воде жидкости. Многие из них имеют приятный запах. Так, например, бутилбутират имеет запах ананаса, изоамилацетат — груши и т. д.
Сложные эфиры высших жирных кислот и спиртов — воскообразные вещества, не имеют запаха, в воде не растворимы.
Химические свойства сложных эфиров. 1. Реакция гидролиза, или омыления. Так, как реакция этерификации является обратимой, поэтому в присутствии кислот протекает обратная реакция гидролиза:
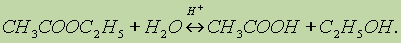
Реакция гидролиза катализируется и щелочами; в этом случае гидролиз необратим, так как получающаяся кислота со щелочью образует соль:
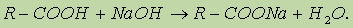
2. Реакция присоединения. Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт, способны к реакциям присоединения.
3. Реакция восстановления. Восстановление сложных эфиров водородом приводит к образованию двух спиртов:
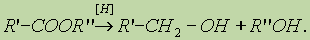
4. Реакция образования амидов. Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты:

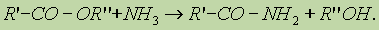
Жиры.
Среди сложных эфиров особое место занимают природные эфиры — жиры и масла, которые образованы трехатомным спиртом глицерином и высшими жирными кислотами, содержащими четное число углеродных атомов. Жиры входят в состав растительных и животных организмов и служат одним из источников энергии живых организмов, которая выделяется при окислении жиров.
Общая формула жиров:
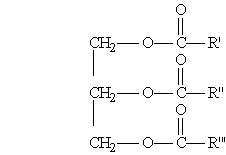
где R', R", R"' — углеродные радикалы.
Жиры бывают “простыми” и “смешанными”. В состав простых жиров входят остатки одинаковых кислот (т. е. R’ = R" = R'"), в состав смешанных — различных.
В жирах наиболее часто встречаются следующие жирные кислоты:
Алкановые кислоты
1. Масляная к-та СН3 — (CH2)2 — СООН
2. Капроновая к-та СН3 — (CH2)4 — СООН
3. Пальмитиновая к-та СН3 — (CH2)14 — СООН
4. Стеариновая к-та СН3 — (CH2)16 — СООН
Алкеновые кислоты
5. Олеиновая к-та С17Н33СООН
СН3—(СН2)7—СН === СН—(СН2)7—СООН
Алкадиеновые кислоты
6. Линолевая к-та С17Н31СООН
СН3—(СН2)4—СН = СН—СН2—СН = СН—СООН
Алкатриеновые кислоты
7. Линоленовая к-та С17Н29СООН
СН3СН2СН = CHCH2CH == CHCH2CH = СН(СН2)4СООН
Физические свойства. По агрегатному состоянию при комнатной температуре жиры делятся на жидкие и твердые. Твердые жиры, как правило, образованы предельными кислотами, жидкие жиры (их часто называют маслами) — непредельными.
Жиры растворимы в органических растворителях и нерастворимы в воде.
Химические свойства. 1. Гидролиз, или омыление, жиров происходит под действием воды (обратимо) или щелочей (необратимо). При щелочном гидролизе образуются соли высших жирных кислот, называемые мылами.
2. Гидрогенизацией жиров называется процесс присоединения водорода к остаткам непредельных кислот, при этом жиры из жидких превращаются в твердые.
Мыла — это соли высших карбоновых кислот. Обычные мыла состоят главным образом из смеси солей пальмитиновой, стеариновой и олеиновой кислот. Натриевые соли образуют твердые мыла, калиевые соли — жидкие мыла.
Мыла получаются при гидролизе жиров в присутствии щелочей:
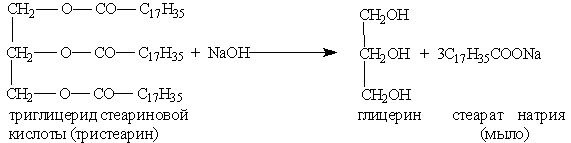
Отсюда реакция, обратная этерификации, получила название реакции омыления. Омыление жиров может протекать и в присутствии серной кислоты (кислотное омыление). При этом получаются глицерин и высшие карбоновые кислоты. Последние действием щелочи или соды переводят в мыла. Исходным сырьем для получения мыла служат растительные масла (подсолнечное, хлопковое и др.), животные жиры, а также гидроксид натрия или кальцинированная сода. Растительные масла предварительно подвергаются гидрогенизации, т. е. их превращают в твердые жиры. Применяются также заменители жиров — синтетические карбоновые жирные кислоты с большей молекулярной массой. Производство мыла требует больших количеств сырья, поэтому поставлена задача получения мыла из непищевых продуктов. Необходимые для производства мыла карбоновые кислоты получают окислением парафина. Нейтрализацией кислот, содержащих от 10 до 16 углеродных атомов в молекуле, получают туалетное мыло, а из кислот, содержащих от 17 до 21атома углерода, — хозяйственное мыло и мыло для технических целей. Как синтетическое мыло, так и мыло, получаемое из жиров, плохо моет в жесткой воде. Поэтому наряду с мылом из синтетических кислот производят моющие средства из других видов сырья, например из алкилсульфатов — солей сложных эфиров высших спиртов и серной кислоты. В общем виде образование таких солей можно изобразить уравнениями:
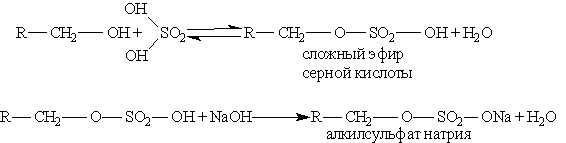
Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках.
Синтетические моющие средства высвобождают сотни тысяч тонн пищевого сырья — растительных масел и жиров.
9. Азотсодержащие органические соединения
Нитросоединения. Нитросоединениями называются органические вещества, в молекулах которых содержится нитрогруппа — NO2 при атоме углерода.
Их можно рассматривать как производные углеводородов, получающиеся путем замещения атома водорода на нитрогруппу. По числу нитрогрупп различают моно-, ди- и полинитросоединения.
Названия нитросоединемий производят от названий исходных углеводородов с добавлением приставки нитро-:
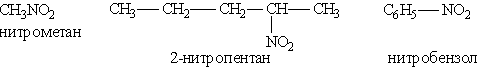
Общая формула этих соединений R—NO2.
Введение в органическое вещество нитрогруппы называется нитрованием. Его можно проводить разными способами. Нитрование ароматических соединений легко осуществимо при действии смесью концентрированных азотной и серной кислот (первая — нитрующий агент, вторая — водоотнимающий):
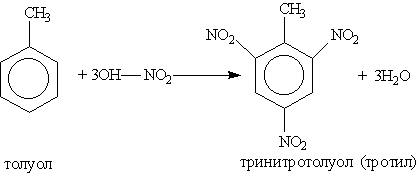
Тринитротолуол хорошо известен как взрывчатое вещество. Взрывается только от детонации. Горит коптящим пламенем без взрыва.
Нитрование предельных углеводородов проводится при действии на углеводороды разбавленной азотной кислотой при нагревании и повышенном давлении (реакция М.И. Коновалова):
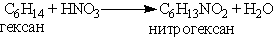
Нитросоединения часто также получают взаимодействием алкил-галогенидов с нитритом серебра:
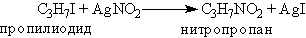
При восстановлении нитросоединений образуются амины.
Азотсодержащие гетероциклические соединения. Гетероциклические соединения — это органические соединения, содержащие в своих молекулах кольца (циклы), в образовании которых кроме атома углерода принимают участие и атомы других элементов.
Атомы других элементов, входящие в состав гетероцикла, называются гетероатомами. Наиболее часто встречаются в составе гетероциклов гетероатомы азота, кислорода, серы, хотя могут существовать гетероциклические соединения с самыми различными элементами, имеющими валентность не менее двух.
Гетероциклические соединения могут иметь в цикле 3, 4, 5, 6 и более атомов. Однако наибольшее значение имеют пяти- и шестичленные гетероциклы. Эти циклы, как и в ряду карбоциклических соединений, образуются наиболее легко и отличаются наибольшей прочностью. В гетероцикле может содержаться один, два и более гетероатомов.
Во многих гетероциклических соединениях электронное строение связей в кольце такое же, как и в ароматических соединениях. Поэтому типичные гетероциклические соединения условно обозначают не только формулами, содержащими чередующиеся двойные и одинарные связи, но и формулами, в которых сопряжение -электронов обозначается кружком, вписанным в формулу.
Для гетероциклов обычно пользуются эмпирическими названиями.
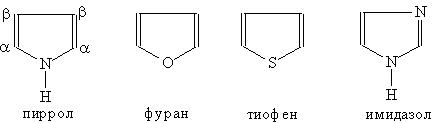
Пятичленные гетероциклы
Шестичленные гетероциклы
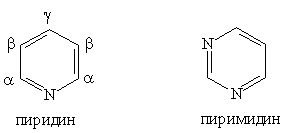
Большое значение имеют гетероциклы, конденсированные с бензольным кольцом или с другим гетероциклом, например пурин:
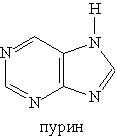
Шестичленные гетероциклы. Пиридин C5H5N — простейший шестичленный ароматический гетероцикл с одним атомом азота. Его можно рассматривать как аналог бензола, в котором одна группа СН заменена на атом азота:
Пиридин представляет собой бесцветную жидкость, немного легче воды, с характерным неприятным запахом; с водой смешивается в любых отношениях. Пиридин и его гомологи выделяют из каменноугольной смолы. В лабораторных условиях пиридин можно синтезировать из синильной кислоты и ацетилена:
Химические свойства пиридина определяются наличием ароматической системы, содержащей шесть -электронов, и атома азота с неподеленной электронной парой.
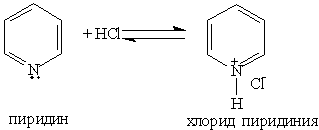
1. Основные свойства. Пиридин — более слабое основание, чем алифатические амины. Его водный раствор окрашивает лакмус в синий цвет:
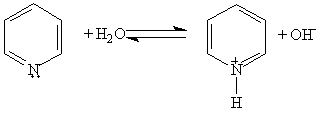
При взаимодействии пиридина с сильными кислотами образуются соли пиридиния:
2. Ароматические свойства. Подобно бензолу, пиридин вступает в реакции электрофильного замещения, однако, его активность в этих реакциях ниже, чем бензола, из-за большой электроотрицательности атома азота. Пиридин нитруется при 300 °С с низким выходом:
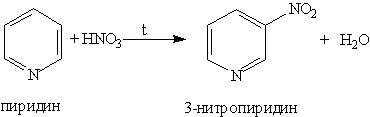
Атом азота в реакциях электрофильного замещения ведет себя как заместитель 2-го рода, поэтому электрофильное замещение происходит в мета-положение.
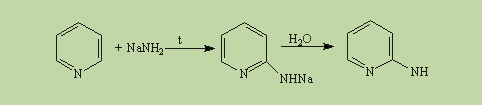
В отличие от бензола пиридин способен вступать в реакции нуклеофильного замещения, поскольку атом азота оттягивает на себя электронную плотность из ароматической системы и орто-пара-положения по отношению к атому азота обеднены электронами. Так, пиридин может реагировать с амидом натрия, образуя смесь орто- и пара-аминопиридинов (реакция Чичибабина):
При гидрировании пиридина ароматическая система разрушается и образуется пиперидин, который представляет собой циклический вторичный амин и является гораздо более сильным основанием, чем пиридин:
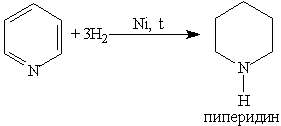
Пиримидин C4H4N2 — шестичленный гетероцикл с двумя атомами азота. Его можно рассматривать как аналог бензола, в котором две группы СН заменены на атомы азота:
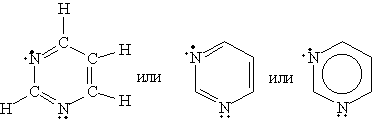
Благодаря наличию в кольце двух электроотрицательных атомов азота пиримидин еще менее активен в реакциях электрофильного замещения, чем пиридин. Его основные свойства также выражены слабее, чем у пиридина.
Основное значение пиримидина состоит в том, что он является родоначальником класса пиримидиновых оснований.
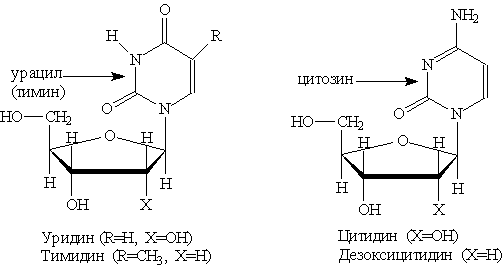
Пиримидиновые основания — производные пиримидина, остатки которых входят в состав нуклеиновых кислот: урацил, тимин, цитозин.
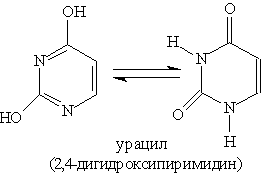
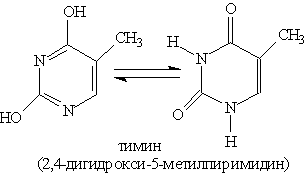
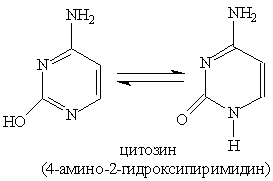
Каждое из этих оснований может существовать в двух формах. В свободном состоянии основания существуют в ароматической форме, а в состав нуклеиновых кислот они входят в NH-форме.
Соединения с пятичленным циклом. Пиррол C4H4NH - пятичленныи гетероцикл с одним атомом азота.
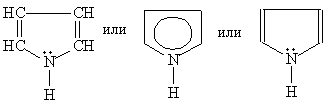
Ароматическая система содержит шесть -электронов (по одному от четырех атомов углерода и пара электронов атома азота). В отличие от пиридина электронная пара атома азота в пирроле входит в состав ароматической системы, поэтому пиррол практически лишен основных свойств.
Пиррол — бесцветная жидкость с запахом, напоминающим запах хлороформа. Пиррол слабо растворим в воде (< 6%), но растворим в органических растворителях. На воздухе быстро окисляется и темнеет.
Пиррол получают конденсацией ацетилена с аммиаком:
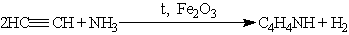
или аммонолизом пятичленных циклов с другими гетероатомами (реакция Юрьева):
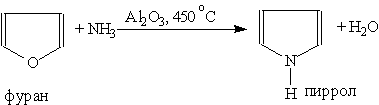
Сильные минеральные кислоты могут вытягивать электронную пару атома азота из ароматической системы, при этом ароматичность нарушается и пиррол превращается в неустойчивое соединение, которое сразу полимеризуется. Неустойчивость пиррола в кислой среде называется ацидофобностью.
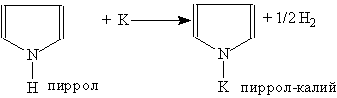
Пиррол проявляет свойства очень слабой кислоты. Он реагирует с калием, образуя пиррол-калий:
Пиррол, как ароматическое соединение, склонен к реакциям электрофильного замещения, которые протекают преимущественно у -атома углерода (соседнего с атомом азота).
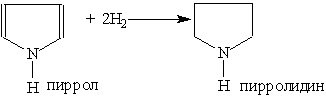
При гидрировании пиррола образуется пирролидин — циклический вторичный амин, проявляющий основные свойства:
Пурин — гетероцикл, включающий два сочлененных цикла: пиридиновый и имидазольный:
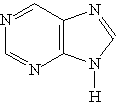
Ароматическая система пурина включает десять -электронов (восемь электронов двойных связей и два электрона пиррольного атома азота). Пурин — амфотерное соединение. Слабые основные свойства пурина связаны с атомами азота шестичленного цикла, а слабые кислотные свойства — с группой NH пятичленного цикла.
Основное значение пурина состоит в том, что он является родоначальником класса пуриновых оснований.
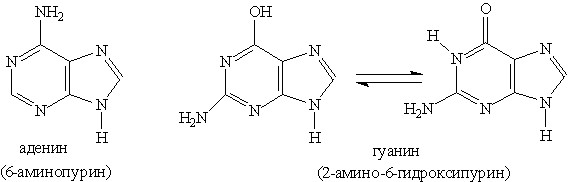
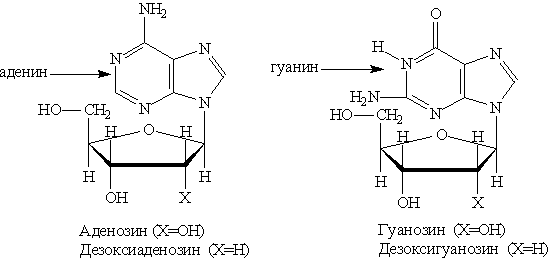
Пуриновые основания — производные пурина, остатки которых входят в состав нуклеиновых кислот: аденин, гуанин.
Нуклеиновые кислоты.
Нуклеиновые кислоты — это природные высокомолекулярные соединения (полинуклеотиды), которые играют огромную роль в хранении и передаче наследственной информации в живых организмах. Молекулярная масса нуклеиновых кислот может меняться от сотен тысяч до десятков миллиардов. Они были открыты и выделены из клеточных ядер еще в XIX в., однако их биологическая роль была выяснена только во второй половине XX в.
Строение нуклеиновых кислот можно установить, анализируя продукты их гидролиза. При полном гидролизе нуклеиновых кислот образуется смесь пиримидиновых и пуриновых оснований, моносахарид ( -рибоза или -дезоксирибоза) и фосфорная кислота. Это означает, что нуклеиновые кислоты построены из фрагментов этих веществ.
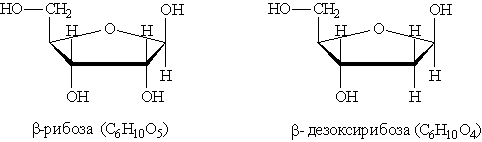
При частичном гидролизе нуклеиновых кислот образуется смесь нуклеотидов, молекулы которых построены из остатков фосфорной кислоты, моносахарида (рибозы или дезоксирибозы) и азотистого основания (пуринового или пиримидинового). Остаток фосфорной кислоты связан с 3-м или 5-м атомом углерода моносахарида, а остаток основания — с первым атомом углерода моносахарида. Общие формулы нуклеотидов:
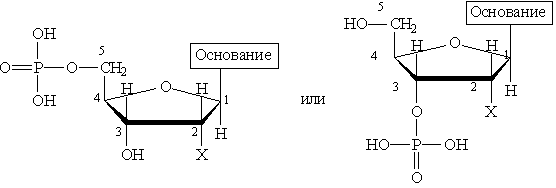
где Х=ОН для рибонуклеотидов, построенных на основе рибозы, и Х==Н для дезоксирибонуклеотидов, построенных на основе дезоксирибозы. В зависимости от типа азотистого основания различают пуриновые и пиримидиновые нуклеотиды.
Нуклеотид — основная структурная единица нуклеиновых кислот, их мономерное звено. Нуклеиновые кислоты, состоящие из рибонуклеотидов, называют рибонуклеиновыми кислотами (РНК). Нуклеиновые кислоты, состоящие из дезоксирибонуклеотидов, называют дезоксирибонуклеиновыми кислотами (ДНК). В состав молекул РНК входят нуклеотиды, содержащие основания аденин, гуанин, цитозин и урацил. В состав молекул ДНК входят нуклеотиды, содержащие аденин, гуанин, цитозин и тимин. Для обозначения оснований используют однобуквенные сокращения: аденин — А, гуанин — G, тимин — Т, цитозин — С, урацил — U.
Свойства ДНК и РНК определяются последовательностью оснований в полинуклеотидной цепи и пространственным строением цепи. Последовательность оснований содержит генетическую информацию, а остатки моносахаридов и фосфорной кислоты играют структурную роль (носители, оснований).
При частичном гидролизе нуклеотидов отщепляется остаток фосфорной кислоты и образуются нуклеозиды, молекулы которых состоят из остатка пуринового или пиримидинового основания, связанного с остатком моносахарида — рибозы или дезоксирибозы. Структурные формулы основных пуриновых и пиримидиновых нуклеозидов:
Пуриновые нуклеозиды:
Пиримидиновые нуклеозиды:
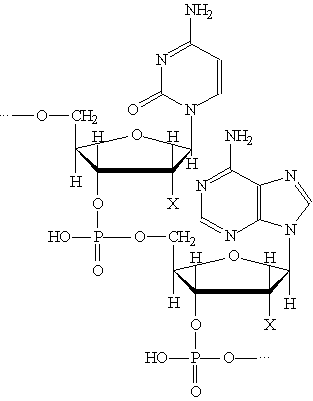
В молекулах ДНК и РНК отдельные нуклеотиды связаны в единую полимерную цепь за счет образования сложноэфирных связей между остатками фосфорной кислоты и гидроксильными группами при 3-м и 5-м атомах углерода моносахарида:
Пространственная структура полинуклеотидных цепей ДНК и РНК была определена методом рентгено-структурного анализа. Одним из самых крупных открытий биохимии XX в. оказалась модель двухспиральной структуры ДНК, которую предложили в 1953 г. Дж. Уотсон и Ф. Крик. Согласно этой модели, молекула ДНК представляет собой двойную спираль и состоит из двух полинуклеотидных цепей, закрученных в противоположные стороны вокруг общей оси. Пуриновые и пиримидиновые основания расположены внутри спирали, а остатки фосфата и дезоксирибозы — снаружи. Две спирали удерживаются вместе водородными связями между парами оснований. Важнейшее свойство ДНК — избирательность в образовании связей (комплементарность). Размеры оснований и двойной спирали подобраны в природе таким образом, что тимин (Т) образует водородные связи только с аденином (А), а цитозин (С) — только с гуанином (G).
Таким образом, две спирали в молекуле ДНК комплементарны друг другу. Последовательность нуклеотидов в одной из спиралей однозначно определяет последовательность нуклеотидов в другой спирали.
В каждой паре оснований, связанных водородными связями, одно из оснований — пуриновое, а другое — пиримидиновое. Отсюда следует, что общее число остатков пуриновых оснований в молекуле ДНК равно числу остатков пиримидиновых оснований.
Длина полинуклеотидных цепей ДНК практически неограниченна. Число пар оснований в двойной спирали может меняться от нескольких тысяч у простейших вирусов до сотен миллионов у человека.
В отличие от ДНК молекулы РНК состоят из одной полинуклеотидной цепи. Число нуклеотидов в цепи колеблется от 75 до нескольких тысяч, а молекулярная масса РНК может изменяться в пределах от 2500 до нескольких миллионов. Полинуклеотидная цепь РНК не имеет строго определенной структуры.
Биологическая роль нуклеиновых кислот. ДНК— главная молекула в живом организме. Она хранит генетическую информацию, которую передает от одного поколения к другому. В молекулах ДНК в закодированном виде записан состав всех белков организма. Каждой аминокислоте, входящей в состав белков, соответствует свой код в ДНК, т. е. некоторая последовательность азотистых оснований.
ДНК содержит всю генетическую информацию, но непосредственно в синтезе белков не участвует. Роль посредника между ДНК и местом синтеза белка выполняет РНК. Процесс синтеза белка на основе генетической информации схематично можно разбить на две основные стадии: считывание информации (транскрипция) и синтез белка (трансляция).
Клетки содержат три типа РНК, которые выполняют различные функции.
1. Информационная, или матричная. РНК (ее обозначают мРНК) считывает и переносит генетическую информацию от ДНК, содержащейся в хромосомах, к рибосо-мам, где происходит синтез белка со строго определенной последовательностью аминокислот.
2. Транспортная РНК (тРНК) переносит аминокислоты к рибосомам, где они соединяются пептидной связью в определенной последовательности, которую задает мРНК.
3. Рибосомная РНК (рРНК) непосредственно участвует в синтезе белков в рибосомах. Рибосомы — это сложные надмолекулярные структуры, которые состоят из четырех рРНК и нескольких десятков белков. Фактически рибосомы — это фабрики по производству белков.
Все виды РНК синтезируются на двойной спирали ДНК.
Последовательность оснований в мРНК — это генетический код, управляющий последовательностью аминокислот в белках. Он был расшифрован в 1961—1966 гг. Замечательная особенность генетического кода состоит в том, что он универсален для всех живых организмов. Одинаковым основаниям в разных РНК (будь то РНК человека или вируса) соответствуют одинаковые аминокислоты. Каждой аминокислоте соответствует своя последовательность из трех оснований, называемая кодоном. Некоторые аминокислоты кодируются несколькими кодонами. Так, лейцину, серину и аргинину соответствует по шесть кодонов, пяти аминокислотам — по четыре кодона, изолейцину — три кодона, девяти аминокислотам — по два кодона, а метионину и триптофану — по одному. Три кодона являются сигналами для прекращения синтеза полипептидной цепи и называются кодонами-терминаторами.
Амины. Амины — органические соединения, которые можно рассматривать как производные аммиака, в котором атомы водорода (один или несколько) замещены на углеводородные радикалы.
В зависимости от природы радикала амины могут быть алифатическими (предельными и непредельными), алициклическими, ароматическими, гетероциклическими. Они подразделяются на первичные, вторичные, третичные в зависимости от того, сколько атомов водорода замещено на радикал.
Четвертичные аммониевые соли типа [R4N]+Cl — это органические аналоги неорганических аммониевых солей.
Названия первичных аминов обычно производят от названий соответствующих углеводородов, добавляя к ним приставку амино- или окончание -амин. Названия вторичных и третичных аминов чаще всего образуют по принципам рациональной номенклатуры, перечисляя имеющиеся в соедин






