В ходе реакции в молекулах реагирующих веществ разрываются одни химические связи и образуются другие. Органические реакции классифицируются по типу разрыва химических связей в реагирующих частицах. Из их числа можно выделить две большие группы реакций — радикальные и ионные.
Радикальные реакции — это процессы, идущие с гомолитическим разрывом ковалентной связи. При гомолитическом разрыве пара электронов, образующая связь, делится таким образом, что каждая из образующихся частиц получает по одному электрону. В результате гомолитического разрыва образуются свободные радикалы:
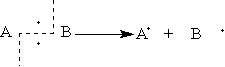
Нейтральный атом или частица с неспаренным электроном называется свободным радикалом.
Ионные реакции — это процессы, идущие с гетеролитическим разрывом ковалентных связей, когда оба электрона связи остаются с одной из ранее связанных частиц:

В результате гетеролитического разрыва связи получаются заряженные частицы: нуклеофильная и электрофильная.
Нуклеофильная частица (нуклеофил) — это частица, имеющая пару электронов на внешнем электронном уровне. За счет пары электронов нуклеофил способен образовывать новую ковалентную связь.
Электрофильная частица (электрофил) — это частица, имеющая незаполненный внешний электронный уровень. Электрофил представляет незаполненные, вакантные орбитали для образования ковалентной связи за счет электронов той частицы, с которой он взаимодействует.
В органической химии все структурные изменения рассматриваются относительно атома (или атомов) углерода, участвующего в реакции. Наиболее часто встречаются следующие типы превращений:
присоединение
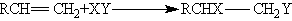
замещение

отщепление
(элиминирование)

полимеризация

В соответствии с вышеизложенным хлорирование метана под действием света классифицируют как радикальное замещение, присоединение галогенов к алкенам — как электрофильное присоединение, а гидролиз алкилгалогенидов — как нуклеофильное замещение.
Алканы и циклоалканы
В соответствии со строением углеродного скелета углеводороды делят на алифатические (с открытой углеродной цепью) и циклические (с замкнутой углеродной цепью). В зависимости от типа связей между атомами углерода как алифатические, так и циклические углеводороды делятся на насыщенные, содержащие только -связи, и ненасыщенные, содержащие как так и -связи.
К насыщенным углеводородам принадлежат алканы и циклоалканы.
Алканы. Алканы являются насыщенными, или предельными, углеводородами, поскольку все свободные валентности атомов углерода заняты (полностью “насыщены”) атомами водорода. Алканы называют также насыщенными углеводородами, или парафинами (термин “парафины” означает “имеющие малое сродство”)
Простейшим представителем алканов служит метан СН4. Начиная с него, можно построить ряд, в котором каждый последующий углеводород отличается от предыдущего на одну группу СH2. Общая формула гомологического ряда алканов СnН2n+2.
По систематической номенклатуре ИЮПАК первым четырем членам гомологического ряда алканов присвоены их исторически сложившиеся названия — метан, этан, пропан, бутан. Названия остальных алканов с нормальной. т. е. неразветвленной углеродной цепью, составляются из греческого или латинского названий числительного, соответствующего числу атомов углерода в цепи, с добавлением суффикса -ан. Так, греческое название числительного 5 — “пента”, отсюда углеводород С5Н12 называется пентан. Для этого же соединения можно встретить название н-пентан, что подчеркивает наличие нормальной цепи.
Начиная с бутана и далее для каждого нормального алкана существуют структурные изомеры с разветвленной цепью.
Атомы углерода различаются по местоположению в цепи. Атом углерода, стоящий в начале цепи, связан только с одним соседним атомом углерода и называется первичным. Атом углерода, связанный с двумя другими атомами углерода, называется вторичным, с тремя — третичным, с четырьмя — четвертичным. В молекулах нормальных алканов содержатся первичные (на концах цепи) и вторичные (в цепи) атомы углерода. Третичные и четвертичные атомы содержатся только в алканах с разветвленной цепью. Все эти атомы углерода несколько различаются по реакционной способности.
Структурная изомерия обусловливает и многообразие углеводородных радикалов. Углеводородный радикал получается, если от молекулы алкана отнять один атом водорода. Этот термин не следует путать с понятием “свободный радикал”, характеризующим атом с неспаренным электроном.
Название радикала производят от названия соответствующего алкана с заменой суффикса -ан на суффикс -ил. В общем виде радикалы, произведенные от алифатических углеводородов, называют алкильными и обозначают R.
Изомерия радикалов начинается с пропана, для которого возможны два изомерных радикала. Если атом водорода отнять от первичного атома углерода, то получится радикал пропил (н-пропил), если от вторичного — получится радикал изопропил.
Физические свойства. В обычных условиях первые четыре члена гомологического ряда алканов (С1—С4)— газы. Нормальные алканы от пентана до гептадекана (С5—С17) — жидкости, начиная с С18 и выше — твердые вещества. По мере увеличения числа атомов углерода в цепи, т. е. с ростом относительной молекулярной массы, возрастают температуры кипения и плавления алканов. При одинаковом числе атомов углерода в молекуле алканы с разветвленным строением имеют более низкие температуры кипения, чем нормальные алканы.
Алканы практически нерастворимы в воде, так как их молекулы малополярны и не взаимодействуют с молекулами воды. Жидкие алканы легко смешиваются друг с другом. Они хорошо растворяются в неполярных органических растворителях, таких, как бензол, тетрахлорметан и др.
Получение. Метан широко распространен в природе. Он является главной составной частью многих горючих газов как природных (90-98%), так и искусственных, выделяющихся при сухой перегонке дерева, торфа, каменного угля, а также при крекинге нефти. Природные газы, особенно попутные газы нефтяных месторождений, помимо метана содержат этан, пропан, бутан и пентан.
Метан выделяется со дна болот и из каменноугольных пластов в рудниках, где он образуется при медленном разложении растительных остатков без доступа воздуха. Поэтому метан часто называют болотным газом или рудничным газом.
1. Получение из ненасыщенных углеводородов.
Взаимодействие алканов с водородом происходит в присутствии металлических катализаторов (Ni, Pd) при нагревании:

2. Получение из галогенопроизводных.
При нагревании моногалогенозамещенных алканов с металлическим натрием получают алканы с удвоенным числом атомов углерода (реакция Вюрца):

Подобную реакцию не проводят с двумя разными галогенозамещенными алканами, поскольку при этом получается смесь трех различных алканов.
3. Получение из солей карбоновых кислот.
При сплавлении безводных солей карбоновых кислот с щелочами получаются алканы, содержащие на один атом углерода меньше по сравнению с углеродной цепью исходных карбоновых кислот:

4. Получение метана.
В электрической дуге, горящей в атмосфере водорода, образуется значительное количество метана:
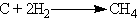
Такая же реакция идет при нагревании углерода в атмосфере водорода до 400—500 °С при повышенном давлении в присутствии катализатора.
В лабораторных условиях метан часто получают из карбида алюминия:

Химические свойства. В обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированными серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями — перманганатом калия КмnО4 и т. п.
Химическая устойчивость алканов объясняется высокой прочностью -связей С—С и С—Н, а также их неполярностью. Неполярные связи С—С и С—Н в алканах не склонны к ионному разрыву, но способны расщепляться гомолитически под действием активных свободных радикалов. Поэтому для алканов характерны, радикальные реакции, в результате которых получаются соединения, где атомы водорода замещены на другие атомы или группы атомов. Aлканы вступают в реакции, протекающие по механизму радикального замещения, обозначаемого символом SR (от англ.substitution radicalic). По этому механизму легче всего замещаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода.
1. Галогенирование.
При взаимодействии алканов с галогенами (хлором и бромом) под действием УФ-излучения или высокой температуры образуется смесь продуктов от моно- до полигалогенозамещенных алканов. Общая схема этой реакции показана на примере метана:

2. Нитрование (реакция Коновалова).
При действии разбавленной азотной кислоты на алканы при 140 "С и небольшом давлении протекает радикальная реакция:
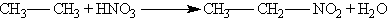
3. Изомеризация.
Нормальные алканы при определенных условиях могут превращаться в алканы с разветвленной цепью:
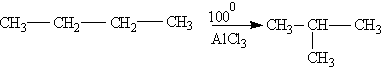
4. Окисление.
При мягком окислении метана кислородом воздуха в присутствии различных катализаторов могут быть получены метиловый спирт, формальдегид, муравьиная кислота:
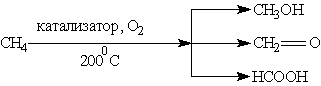
На воздухе алканы сгорают до СО2 и Н2О.
Применение алканов. Оно весьма разнообразно. Благодаря большой теплотворной способности метан в больших количествах расходуется в качестве топлива (в быту — бытовой газ и в промышленности). Широко применяются получаемые из него вещества: водород, ацетилен, сажа. Он служит исходным сырьем для получения формальдегида, метилового спирта, а также различных синтетических продуктов.
Большое промышленное значение имеет окисление высших предельных углеводородов — парафинов с числом углеродных атомов 20-25. Этим путем получают синтетические жирные кислоты с различной длиной цепи, которые используются для производства мыл, различных моющих средств, смазочных материалов, лаков и эмалей.
Жидкие углеводороды используются как горючее (они входят в состав бензина и керосина). Алканы широко используются в органическом синтезе.
Циклоалканы.
Общая формула гомологического ряда циклоалканов С2Н2n. Точно такой же формулой описывается гомологический ряд алкенов, из чего следует, что каждому циклоалкану изомерен соответствующий алкен — это приме так называемой “межклассовой” изомерии.
По размеру цикла циклоалканы делятся на ряд групп, из которых мы рассмотрим малые (С3, С4) и обычные (С5—С7) циклы.
Названия циклоалканов строятся путем добавления приставки цикло- к названию алкана с соответствующим числом атомов углерода. Нумерацию в цикле производят таким образом, чтобы заместители получили наименьшие номера.
Структурные формулы циклоалканов обычно записывают в сокращенном виде, используя геометрическую форму цикла и опуская символы атомов углерода и водорода.

Структурная изомерия циклоалканов обусловлена размером цикла (например, циклобутан и метилцикло-пропан — изомеры) и положением заместителей в цикле (например, 1,1- и 1,2-диметилбутан).
Для циклоалканов характерен еще один вид изомерии — пространственная изомерия, связанная с различным расположением заместителей относительно плоскости цикла. При их расположении по одну сторону от плоскости цикла получается цис-изомер, по разные стороны — транс-изомер.
Физические свойства. Первые два члена этого ряда — газы, С5—С16 — жидкости, начиная с С17 и выше — твердые вещества. Температуры кипения и плавления циклоалканов несколько выше, чем у алканов при одинаковом числе атомов углерода.
Получение. Общим способом получения циклоалканов является действие металлов на дигалогенопро-изводные алканов:

Соединения ряда циклогексана получают гидрированием ароматических углеводородов, например:

Химические свойства. В строении циклоалканов имеется ряд особенностей, определяющих их химические свойства. Малые циклы (особенно циклопропан) неустойчивы и способны к разрыву, поэтому они склонны к реакциям присоединения, напоминая ненасыщенные соединения. Так, циклопропан присоединяет бром с разрывом цикла, образуя 1,3-дибромпропан (реакция идет труднее, чем с пропеном):
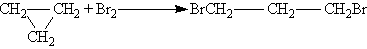
Обычные циклы очень устойчивы и вступают только в реакции замещения, подобно алканам:

Алкены и циклоалкены
Алкенами называются ненасыщенные углеводороды, молекулы которых содержат одну двойную связь. Атомы углерода, связанные двойной связью, находятся в состоянии sp2-гибридизации, двойная связь является сочетанием - и -связей. Общая формула гомологического ряда алкенов СnН2n.
По систематической номенклатуре названия алкенов строятся так, что в названии алкана, соответствующего этой родоначальной структуре, суффикс -ан заменяется на -ен. В случае разветвления главной считается цепь, содержащая двойную связь, даже если эта цепь и не является самой длинной. Общее международное название этиленовых углеводородов — алкены. Непредельные углеводороды ряда этилена, содержащие одну двойную связь, называются олефинами.
Углеводородные радикалы, образованные из алкенов, имеют суффикс -енил. Некоторые радикалы имеют тривиальные названия, например, винил (этенил), аллил (пропенил).
Структурная изомерия алкенов обусловлена не только строением углеродного скелета, как это свойственно алканам, но и положением двойной связи в главной углеродной цепи. Первым гомологом, для которого осуществляется изомерия с учетом этих двух признаков, является алкен C4Н8.
Пространственная изомерия алкенов обусловлена наличием в молекуле двойной связи и различным расположением заместителей относительно плоскости -связи. Многие алкены могут существовать в виде цис- и транс-изомеров.
Физические свойства. По физическим свойствам алкены мало отличаются от алканов с тем же числом атомов в молекуле. Низшие гомологи С2—С4 при нормальных условиях — газы, С5—С17 — жидкости, высшие гомологи — твердые вещества. Алкены нерастворимы в воде, хорошо растворимы в органических растворителях.
Способы получения. Алкены являются ценным сырьем для промышленного органического синтеза. В природе они практически не встречаются, поэтому разработано много методов получения алкенов различного строения.
1. Крекинг алканов.
Крекингом обычно называют процессы химических превращений органических соединений, происходящие при высокой температуре. Крекинг алканов является важнейшим промышленным способом получения алкенов из высококипящих фракций нефти. Под действием сильного нагревания (до 700 °С) в молекулах алканов гомолитически расщепляются -связи С—С, при этом образуется смесь низкомолекулярных алканов и алкенов:

2. Реакции элиминирования. Эта группа реакций лежит в основе большинства способов получения алкенов.
Элиминирование — это отщепление двух атомов или групп атомов от соседних атомов углерода с образованием между ними -связи.. Атомы углерода при элиминировании переходят из sр3- в sp2-гибридное состояние. Исходными веществами могут служить представители разных классов органических соединений.
а) Дегидрогалогенирование происходит при действии спиртовых растворов щелочей на моногалогениды:

В молекуле 2-бромпропана атом водорода отщепляется от любого из соседних атомов углерода, так как они равноценны. В случаях, когда соседние атомы углерода не одинаковы, отщепление атома водорода происходит преимущественно от наименее гидрогенизированного атома углерода (т. е. имеющего наименьшее число атомов водорода). Эта закономерность носит название правила Зайцева.
б) Дегидратация спиртов происходит при их нагревании с серной кислотой или пропускании паров спирта над катализатором.

в) Дегалогенирование происходит при нагревании дигалогенидов, имеющих атомы галогена у соседних атомов углерода, с активными металлами:

г) Дегидрирование алканов проводят при 500 °С в присутствии катализатора:

Химические свойства алкенов определяются наличием в их молекулах двойной связи. Электронное облако -связи подвергается атаке электрофильными агентами. Поэтому многие реакции алкенов протекают по механизму электрофильного присоединения, обозначаемому символом AE (от англ. addition electrophilic). Реакции электрофильного присоединения — это ионные процессы, протекающие в несколько стадий.
Характерной особенностью электронного облака -связи является его подвижность. Под влиянием заместителей электронная плотность -связи может смещаться к одному из атомов углерода. -Связь тогда становится полярной, а на атомах углерода, соединенных двойной связью, возникают частичные заряды. Увеличение полярности в конечном счете может привести к гетерологическому разрыву -связи.

1. Гидрогалогенирование. При взаимодействии алкенов с галогеноводородами (НСl, НВr) образуются галогеналканы, причем если исходный алкен несимметричен, то реакция протекает по правилу Марковникова.
Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкенам водород присоединяется к более гидрогенизированному атому углерода при двойной связи:

2. Гидратация. При взаимодействии алкенов с водой в присутствии минеральных кислот (серной, фосфорной) образуются спирты. Минеральные кислоты выполняют роль катализаторов и являются источниками протонов. Присоединение воды идет по правилу Марковникова:
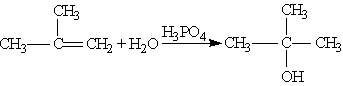
3. Галогенирование. При добавлении к алкену брома (в виде бромной воды) бурая окраска брома быстро исчезает. Эта реакция является качественной на двойную связь:

4. Окисление. При окислении алкенов перманганатом калия КMnO4 в нейтральной или слабощелочной среде происходит разрыв -связи и присоединение гидроксильной группы к каждому атому углерода, т. е. реакция гидроксидирования. В результате реакции окрашенный раствор перманганата калия быстро обесцвечивается и выпадает коричневый осадок оксида марганца (IV). Эта реакция также является качественной на двойную связь.
В связи с тем, что органические соединения при окислении образуют, наряду с основными, ряд побочных продуктов, возникают трудности в уравнивании этих реакций. Поэтому в органической химии сложилась традиция записывать эти реакции в виде схем с обозначением процесса окисления символом [О] (над стрелкой) и процесса восстановления — символом [Н].
При окислении перманганатом калия в кислой среде или хромовой смесью происходит полный разрыв двойной связи с образованием продуктов окисления. Эту реакцию называют окислительным расщеплением двойной связи.
Так, из молекулы бутена-2 в результате окислительного расщепления образуются две молекулы уксусной кислоты:

5. Восстановление (гидрирование). Эта реакция протекает в присутствии катализатора — мелко раздробленного никеля, платины или палладия — при комнатной температуре:

При гидрогенизации олефины превращаются в предельные углеводороды.
6. Реакции полимеризации. Особым типом реакций присоединения к алкенам является их полимеризация, которая может катализироваться как электрофилами, так и радикалами или соединениями переходных металлов.
Реакция полимеризации — это последовательное присоединение молекул ненасыщенных соединений друг к другу с образованием высокомолекулярного продукта — полимера. Молекулы алкена, вступающие в реакцию полимеризации, называются мономерами. Число элементарных звеньев, повторяющихся в макромолекуле, называется степенью полимеризации (обозначается п). В зависимости от степени полимеризации из одних и тех же мономеров можно получать вещества с различными свойствами. Так, полиэтилен с короткими цепями (n = 20) является жидкостью, обладающей смазочными свойствами. Полиэтилен с длиной цепи в 1500-2000 звеньев представляет собой твердый, но гибкий пластический материал, из которого можно получать пленки, изготовлять бутылки и другую посуду, эластичные трубы и т. д. Наконец, полиэтилен с длиной цели в 5-6 тыс. звеньев является твердым веществом, из которого можно готовить литые изделия, жесткие трубы, прочные нити.
Если в реакции полимеризации принимает участие небольшое число молекул, то образуются низкомолекулярные вещества, например димеры, тримеры и т. д. Условия протекания реакций полимеризации весьма различные. В некоторых случаях необходимы катализаторы и высокое давление. Но главным фактором является строение молекулы мономера. В реакцию полимеризации вступают непредельные (ненасыщенные) соединения за счет разрыва кратных связей.
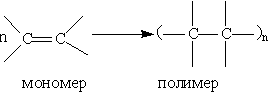
Структурные формулы полимеров кратко записывают так: формулу элементарного звена заключают в скобки и справа внизу ставят букву п. Например, структурная формула полиэтилена (—СН2—СН2—)n. Легко заключить, что название полимера слагается из названия мономера и приставки поли-, например полиэтилен, поливинилхлорид, полистирол и т. д.
Полимеризация — это цепная реакция, и, для того чтобы она началась, необходимо активировать молекулы мономера с помощью так называемых инициаторов. Такими инициаторами реакции могут быть свободные радикалы или ионы (катионы, анионы). В зависимости от природы инициатора различают радикальный, катионный или анионный механизмы полимеризации.
Наиболее распространенными полимерами углеводородной природы являются полиэтилен и полипропилен.
Полиэтилен получают полимеризацией этилена:

Полипропилен получают стереоспецифической полимеризацией пропилена (пропена). Стереоспецифическая полимеризация — это процесс получения полимера со строго упорядоченным пространственным строением.
К полимеризации способны многие другие соединения — производные этилена, имеющие общую формулу СН2==СН—X, где Х — различные атомы или группы атомов.
Применение. Этилен применяется для получения этилового спирта, полиэтилена. Он ускоряет созревание плодов (помидоров, цитрусовых и др.) при введении небольших количеств его в воздух теплиц. Этилен и его гомологи используются как химическое сырье для синтеза многих органических веществ.






