Алкадиенами называются ненасыщенные углеводороды, содержащие две двойные связи. Общая формула алкадиенов СnН2n-2.
О наличии двух двойных связей в молекуле говорит суффикс -диен. Для указания положения каждой двойной связи главную углеродную цепь нумеруют так, чтобы в нее входили обе двойные связи, а атомы углерода, связанные двойными связями, получили наименьшие номера. Для некоторых алкадиенов продолжают использовать тривиальные названия, например изопрен (2-метилбута-диен-1,3).
Если двойные связи разделены в цепи двумя или более -связями (пентадиен-1,4), то такие двойные связи называются изолированными. Химические свойства алкадиенов с изолированными двойными связями такие же, как и у алкенов, с той разницей, что в реакции могут вступать не одна, а две двойные связи независимо друг от друга.
Если двойные связи разделены в цепи только одной -связью, то их называют сопряженными. В этом случае в молекуле двойные и одинарные связи чередуются, как, например, в бутадиене-1,3 СН2==СН—СН==СН2, который является простейшим сопряженным алкадиеном.
Соединения с чередующимся расположением двойных связей отличаются по свойствам как от алкенов, так и от других типов алкадиенов. Особенности химического поведения этих соединений объясняются наличием сопряжения.
Сопряжение — это образование единого электронного облака в результате взаимодействия негибридизованных р-орбиталей в молекуле с чередующимися двойными и одинарными связями.
Так, в бутадиене-1,3 все четыре атома углерода находятся в состоянии sp2-гибридизации. Они лежат в одной плоскости и составляют -скелет молекулы. Негибридизованные р-орбитали каждого атома углерода перпендикулярны плоскости -скелета и параллельны друг другу, что создает условия для их взаимного перекрывания. Перекрывание происходит не только между атомами С -1 —С-2, С-3—С- 4.
но и частично между атомами С-2—С-3. При перекрывании четырех р-орбиталей происходит образование единого -электронного облака, т. е. сопряжение двух двойных связей. Этот тип сопряжения называется , -сопряжением, так как взаимодействуют орбитали -связей.
В сопряженной системе -электроны уже не принадлежат определенным связям, они делокализованы.
Делокализация электронной плотности — это ее распределение по всей сопряженной системе, по всем связям и атомам.
Цепь сопряжения может включать большое число двойных связей. Чем она длиннее, тем больше делокализация -электронов и тем устойчивее молекула.
Способы получения. Важное промышленное значение имеет бутадиен-1,3, или дивинил, так как он является сырьем для производства синтетического каучука. Бутадиен-1,3 получают из бутановой фракции крекинг-процесса нефти. При температуре 600 °С происходит ступенчатое дегидрирование бутана над катализатором (Сr2О3, Al2О3) с образованием бутадиена-1,3:

Каталитический способ получения бутадиена-1,3 из этанола был открыт в 1932 г. С. В. Лебедевым. По способу Лебедева бутадиен-1,3 получается в результате одновременного дегидрирования и дегидратации этанола с катализаторами на основе ZnO и Аl2О3:
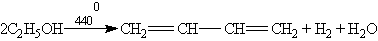
Другим важным представителем алкадиенов является 2-метилбутадиен-1,3, или изопрен, представляющий собой легкокипящую жидкость. Изопрен впервые был получен из натурального каучука сухой перегонкой (нагреванием без доступа воздуха). В настоящее время в промышленности изопрен получают в основном из легких фракций углеводородов, образующихся при крекинг-переработке нефти, например дегидрирования 2-метилбутана на оксидных катализаторах:

Химические свойства.
1. Для алкадиенов характерны реакции электрофилъного присоединения АE. Однако в химическом поведении алкадиенов-1,3 есть особенности, связанные с наличием в их молекуле сопряжения. Так, в реакциях присоединения могут быть получены два продукта. Один из них получается за счет присоединения по любой двойной связи (1,2-присоединение). В этом случае алкадиен ведет себе подобно алкену. Другой продукт получается в результате 1,4-присоединения. В этом случае молекула алкадиена ведет себя как единая сопряженная система, и присоединение к ней идет как бы по ее “концам”. В получающемся продукте между атомами С-2 — С-3 содержится двойная связь.
Преимущественное протекание реакции по тому или иному пути зависит от конкретных условий.
2. Полимеризация.
Применение некоторых полимеров.
Поливинилхлорид — продукт полимеризации хлористого винила (винилхлорида) СН2=СНCl. Структурная формула:

Этот полимер обладает ценными свойствами: он негорюч, устойчив к действию химических реагентов, легко окрашивается. Из пластмасс на его основе изготовляют клеенки, плащи, портфели, искусственную кожу для обуви и т. п. Широко применяется для изоляции проводов и кабелей.
Тефлон — продукт полимеризации тетрафторэтилена:

Это самое инертное органическое вещество (на него оказывают воздействие только расплавленные калий и натрий). Обладает высокой морозо- и теплоустойчивостью.
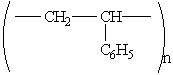
Полистирол — твердое прозрачное упругое вещество. Получается полимеризацией стирола. Структурная формула:
Полистирол широко используется в качестве диэлектрика в электро- и радиотехнике. Идет на изготовление кислотоупорных труб, тары, а также бытовых изделий — расчесок, игрушек и др. Из него готовят легкие пористые пластмассы — пенопласты.
4. Алкины
Алкины. Алкинами называются ненасыщенные углеводороды, молекулы которых содержат одну тройную связь. Общая формула алкинов СnН2n-2.
По номенклатуре ИЮПАК наличие тройной связи в молекуле обозначается суффиксом -ин, который заменяет суффикс -ан в названии соответствующего алкана.
Структурная изомерия алкинов, как и алкенов, обусловлена строением углеродной цепи и положением в ней тройной связи.
Физические свойства. По физическим свойствам алкины напоминают алканы и алкены. Низшие алкины C2—C4 представляют собой газы, С5—C16 — жидкости, высшие алкины — твердые вещества. Температуры кипения алкинов несколько выше, чем у соответствующих алкенов.
Способы получения. 1. Общим способом получения алкинов является реакция дегидрогалогенирования - отщепления двух молекул галогеноводорода от дигалогензамещенных алканов, которые содержат два атома галогена либо у соседних атомов углерода (например, 1,2-дибромпропан), либо у одного атома углерода (2,2-дибромпропан). Реакция происходит под действием спиртового раствора гидроксида калия:

2. Важнейший из алкинов — ацетилен — получают в промышленности путем высокотемпературного крекинга метана:

В лаборатории ацетилен можно получить гидролизом карбида кальция:
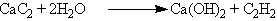
Химические свойства. Тройная связь образуется двумя атомами углерода в sp-гибридном состоянии. Две -связи расположены под углом 180°, а две -связи расположены во взаимно перпендикулярных областях. Наличие -связей обусловливает способность алкинов вступать в реакции электрофильного присоединения. Однако эти реакции для алкинов протекают медленнее, чем для алкенов. Это объясняется тем, что -электронная плотность тройной связи расположена более комплексно, чем в алкенах, и поэтому менее доступна для взаимодействия с различными реагентами.
1. Галогенирование. Галогены присоединяются к алкинам в две стадии. Например, присоединение брома к ацетилену приводит к образованию дибромэтена, который, в свою очередь, реагирует с избытком брома с образованием тетрабромэтана:
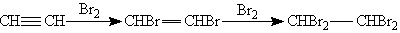
2. Гидрогалогенирование. Галогеноводороды присоединяются к тройной связи труднее, чем к двойной. Для активации галогеноводорода используют АlСl3 — сильную кислоту Льюиса. Из ацетилена при этом можно получить винилхлорид (хлорэтен), который используется для получения важного полимера — поливинилхлорида;

3. Гидратация. Присоединение воды к алкинам катализируется солями ртути (П) (реакция Кучерова):
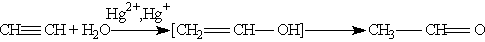
На первой стадии реакции образуется непредельный спирт, в котором гидроксогруппа находится непосредственно у атома углерода при двойной связи. Такие спирты принято называть виниловыми или енолами.
Отличительной чертой большинства енолов является их неустойчивость. В момент образования они изомеризуются в более стабильные карбонильные соединения (альдегиды или кетоны) за счет переноса протона от гидроксильной группы к соседнему атому углерода при двойной связи. При этом -связь между атомами углерода разрывается и образуется -связь между атомом углерода и атомом кислорода. Причиной изомеризации является большая прочность двойной связи С == О по сравнению с двойной связью С == С.
В результате реакции гидратации только ацетилен превращается в альдегид, гидратация гомологов ацетилена протекает по правилу Марковникова, и образующиеся енолы изомеризуются в кетоны. Так, пропин превращается в ацетон:

4. Кислотные свойства. Особенностью алкинов, имеющих концевую тройную связь, является их способность отщеплять протон под действием сильных оснований, т, е, проявлять слабые кислотные свойства. Возможность отщепления протона обусловлена сильной поляризацией -связи С Н. Причиной поляризации является высокая электроотрицательность атома углерода в sp-гибридном состоянии. Поэтому алкины, в отличие от алкенов и алканов, способны образовывать соли, называемые ацетиленидами.

Ацетилениды серебра и меди (I) легко образуются и выпадают в осадок при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди (I). Эта реакция служит для обнаружения алкинов с тройной связью на конце цепи:

Ацетилениды серебра и меди как соли очень слабых кислот легко разлагаются при действии хлороводородной кислоты с выделением исходного алкина:

Таким образом, используя реакции образования и разложения ацетиленидов, можно выделять алкины из смесей с другими углеводородами.
5. Полимеризация. В присутствии катализаторов алкины могут реагировать друг с другом, причем в зависимости от условий образуются различные продукты. Так, под действием водного раствора CuCl и NH4Cl ацетилен димеризуется, давая винилацетилен:
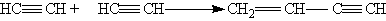
Винилацетилен обладает большой реакционноспособностью; присоединяя хлороводород, он образует хлоропрен, используемый для получения искусственного каучука:

При пропускании ацетилена над активированным углем при 600 °С происходит тримеризация ацетилена с образованием бензола:

6. Реакции окисления и восстановления. Алкины окисляются различными окислителями, в частности перманганатом калия. При этом раствор перманганата калия обесцвечивается, что служит указанием на наличие тройной связи. При окислении обычно происходит расщепление тройной связи и образуются карбоновые кислоты:

В присутствии металлических катализаторов алкины восстанавливаются путем последовательного присоединения молекул водорода, превращаясь сначала в алкены, а затем в алканы:
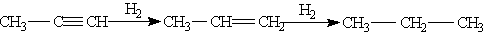
Применение. Ацетилен применяется в качестве исходного сырья для многих промышленных химических синтезов. Из него получают уксусную кислоту, синтетический каучук, поливинилхлоридные смолы. Тетрахлорэтан СНСl2—CHCl2 — продукт присоединения хлора к этилену — служит хорошим растворителем жиров и многих органических веществ и, что очень важно, безопасен в пожарном отношении. Ацетилен используют для автогенной сварки металлов.






