¬ажна€ роль возбужденных состо€ний радикалов в процессах разрушени€ веществ определ€етс€ тем, что радикалы имеют спектры поглощени€, смещенные в длинноволновую область по сравнению со спектрами исходных соединений, что расшир€ет диапазон спектральной чувствительности. Ёти частицы обладают высокими значени€ми мол€рных коэффициентов поглощени€ и способны в конденсированной фазе вступать в фоторадикальные цепные реакции. –ост времени жизни радикалов в основном состо€нии (например, в твердой фазе) увеличивает вклад реакций электронно-возбужденных радикалов.
¬ радикалах неспаренный электрон находитс€ на внешних атомных или молекул€рных орбитал€х, и основное состо€ние радикалов €вл€етс€ дублетным, а электронно-возбужденные состо€ни€ Ч дублетными или квартетными. –асчеты, выполненные дл€ аллильного и бензильного радикалов, показывают, что дублетное состо€ние €вл€етс€ низшим электронно‑возбужденным состо€нием этих радикалов; дезактиваци€ его может происходить в результате флуоресценции или внутренней конверсии. ѕри этом веро€тность дезактивации в результате внутренней конверсии св€зана с изменением геометрии радикала при переходе в возбужденное состо€ние. ѕо всей видимости, лишь дл€ небольшого числа из рассматриваемых нами радикалов, таких, как, например, метильный и аллильный радикалы, эти изменени€ малы, и можно полагать, что основным путем их дезактивации, помимо протекающей в возбужденном состо€нии химической реакции, €вл€етс€ флуоресценци€.
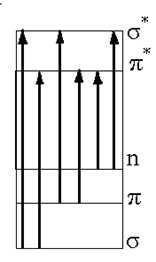
ѕоскольку энергетический уровень неспаренного электрона лежит выше уровней других электронов, то и оптическое поглощение радикалов обычно сдвинуто в длинноволновую область спектра. Ёлектронные состо€ни€ радикалов аналогично состо€ни€м молекул можно классифицировать как σ -, π -, n- состо€ни€, при этом электронные переходы в радикалах можно обозначать так же, как и в молекулах (см. рисунок 9).
|
–исунок 9 Чќдноэлектронные переходы между орбитал€ми в радикалах
¬ соответствии с такой классификацией, в алкильных радикалах наблюдаемое поглощение св€зано с π → σ* - переходом, в аллильных и полиеновых радикалах Ч с π → π* - переходом, в ацильных радикалах
с σ → π* - переходом, в сульфенильных радикалах с σ → σ* - переходом, в пероксидных радикалах с n → π* - переходом и т. д.
ак видно из приведенных ниже данных (рисунок 10 и таблица 2), максимумы полос поглощени€ практически всех видов свободных радикалов расположены в области l = (200 Ц 300) нм. Ѕолее длинноволновым поглощением обладают лишь радикалы, содержащие ароматический структурный фрагмент.
—пектры поглощени€ анионных форм свободных радикалов также претерпевают батохромный сдвиг по сравнению со спектрами недиссоциированных форм.
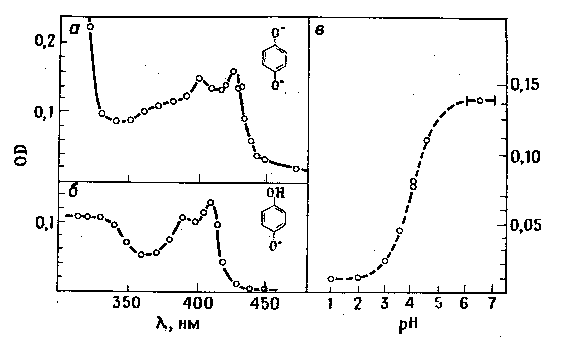
а Ч нейтральный раствор бензохинона (— = 0,001 моль/дм3) и гидрохинона (— = 0,01 моль / дм3), доза облучени€ ƒ = 20 √р, спуст€ 1 мкс после импульса возбуждени€; б Ч рЌ = 2, доза облучени€ ƒ = 20 √р; в Ч крива€ р дл€ семихинона.
|
|
|
Ёкспериментальные точки Ч оптическа€ плотность при λ = 430 нм в зависимости от рЌ, прерывиста€ крива€ Ч теоретическа€ крива€ равновеси€, построенна€ при значени€х р (QH)=4
–исунок 10 Ч —пектры поглощени€ растворов обескислороженных бензохинона и гидрохинона, наблюдаемые при импульсном радиолизе
“аблица 2 Ч —пектральные характеристики некоторых радикалов
| –адикалы | λ, нм | ε × 10-3, дм3 / (моль × см) |
| јлкильные RХ | 216 - 260 | 0,34 - 4,8 |
| јлкоксильные ROХ | 200 - 317 | 0,6 - 0,05 |
| ѕероксидные ROХ2 | 220 - 290 | 0,7Ч3,4 |
| јцильные RCХO | 207 - 230 530 - 550 | 0,9 - 1,0 0,04 - 0,06 |
| јлкоксикарбонильные ROCХO | 2,7 | |
| √идроксиалкильные, R (1)R(2)CХOH | 200 - 290 | 0,2 - 1,7 |
| ѕростых эфиров R(1)R(2)CХOR | 0,4 - 1,5 | |
| —ложных эфиров R(1)R(2)CХOOR, | 300 - 320 | 0,8 - 1,6 |
| RCOOCХR(1)R(2) | ||
| јльдегидов R(1)R (2)CХCHO | 0,26 | |
| етонов R(1)R(2)CCOR | 285 - 315 | 0,85 |
| ислот R(1)R(2)CХCOOH | 240 - 20 | 0,3 - 0,7 |
| јнгидридов кислот R (1)R(2)CХCOOCOR | 0,3 | |
| јллильные ХCH2CH=CHR | 225 - 255 | 2,6 - 7,3 |
| ѕолиеновые RCХH(CH=CH)nR (€=2,3) | 285 - 360 | |
| “иильные RSХ | 0,29 - 0,58 | |
| ѕертиильные RSХ2 | 307 - 380 | 1,7 - 3,3 |
| —ульфенильные RSSХ (H)R | 355 - 415 | 7,0 |
| —ульфонильные RSХO2 | 0,9 - 1,1 | |
| јминоалкильные R (1)R(2)CХNR(3)R(4) | 280 - 350 | 0,58 - 2,2 |
| јлкиламинные R (1)NХR(2) | 260 - 300 | Ч |
| јлкилиминные R (1)R(2)C=NХ | 250 - 300 | 0,15 - 0,6 |
| »зоцианатов R (1)R(2)CХNCO | 1,9 | |
| јмидов R (1)R(2)CХCONH2 | 380 - 490 | 0,6 - 1,0 |
| RCONHCХR (1)R(2) | 225 - 265 310 - 380 | 1,4 - 7,0 1,0 - 2,5 |
| ”ретанов ROCONHCХR (1)R(2) | 1,6 |
онтрольные вопросы и задачи к разделу 2
1 акое врем€ требуетс€ дл€ завершени€ процесса сольватации электрона?
2 „ем определ€етс€ глубина энергетической потенциальной €мы сольватированного электрона?
3 –ассчитайте значение мол€рного коэффициента поглощени€ свободных радикалов в облученном кристалле сахарозы толщиной 5 мм, если оптическа€ плотность в максимуме полосы поглощени€ ј310 = 1, а измеренна€ методом Ёѕ– концентраци€ радикалов в образце составл€ет — = 2 × 10 ‑3 ћ.