Почему водород в периодической системе обычно помещают либо в первой группе и в то же время в скобках в седьмой, либо в седьмой группе и в то же время в скобках в первой. Приведите примеры реакций, доказывающих двойственную химическую природу водорода.
Решение.
Особенность строения электронной оболочки атома водорода (как и гелия), а именно отсутствие промежуточного электронного слоя (его валентный электрон находится непосредственно в сфере действия атомного ядра), не позволяет однозначно решить, в какой группе периодической системы он должен находиться. Если исходить из числа валентных электронов его атома, то водород должен находиться в первой группе. Однако, в отличие от щелочных металлов, водород вследствие высокого значения энергии ионизации не способен образовывать ионных соединений, в которых он был бы катионом. Его соединения, даже с наиболее активными неметаллами, например, фтором, представляют вещества с полярной ковалентной связью.
Если же исходить из того, что для завершения внешнего энергетического слоя атому водорода не хватает одного электрона, его следует поместить в седьмую группу. Атом водорода, как и атомы галогенов, характеризуется высоким значением энергии ионизации.
Таким образом, отдавая один электрон, водород проявляет сходство со щелочными металлами первой группы, а присоединяя электрон – с галогенами седьмой группы. Поэтому водород в периодической системе помещают либо в первой группе и в скобках в седьмой, либо в седьмой группе и в скобках в первой. Вместе с тем водород – элемент особый и его размещение в той или иной группе таблицы в значительной мере условно.
Из вышесказанного следует, что в химических процессах водород может выступать в качестве восстановителя при взаимодействии с окислителями, например, хлором:
 +
+ 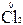 = 2HCl,
= 2HCl,
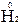 – 2
– 2 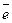 = 2
= 2 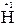 – окисление,
– окисление,
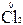 + 2
+ 2 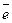 = 2
= 2 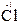 – восстановление.
– восстановление.
Водород может проявлять и окислительные свойства при взаимодействии с сильными восстановителями, например, щелочными металлами:
2M + 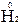 = 2MH,
= 2MH,
2  – 2
– 2 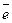 = 2
= 2 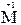 – окисление,
– окисление,
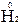 + 2
+ 2 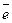 = 2
= 2 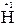 – восстановление.
– восстановление.
Степень окисления водорода в образующихся гидридах металлов – (-1), химическая связь в них ионного типа, в галогеноводородах химическая связь – ковалентная полярная.






