Напишите диссоциацию в растворе следующих комплексных соединений и выражения для констант нестойкости их комплексных ионов: [Zn(NH3)4]Cl2; K2[PtCl6]; K4[Mo(CN)8]; Ba[Pt(NO3)4Cl2]; [Co(NH3)3(H2O)3]Cl3; [Cr(H2O)3Cl3].
Решение.
Диссоциация комплексных соединений определяется характером связи в них. Между внутренней и внешней сферами связь ионного типа, поэтому по первой ступени диссоциация идет полностью с образованием комплексного иона и ионов внешней координационной сферы.
Во внутренней сфере связь между комплексообразователем и лигандами ковалентная (образована по донорно-акцепторному механизму), прочная, поэтому диссоциация по второй ступени идет незначительно и также ступенчато. Диссоциация комплексного иона, как и любого слабого электролита, процесс обратимый и характеризуется константой равновесия, называемой в данном случае константой нестойкости комплексного иона (КН).
Учитывая вышесказанное, напишем уравнения диссоциации и константы нестойкости комплексных ионов:
1. [Zn(NH3)4]Cl2 ® [Zn(NH3)4]2+ + 2Cl–.
2. [Zn(NH3)4]2+ D Zn2+ + 4NH3,
КН = 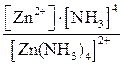 .
.
1. K2[PtCl6] ® 2K+ + [PtCl6]2–.
2. [PtCl6]2– D Pt4+ + 6Cl–,
КН = 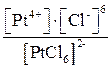 .
.
1. K4[Mo(CN)8] ® 4K+ + [Mo(CN)8]4–.
2. [Mo(CN)8]4– D Mo4+ + 8CN–,
КН = 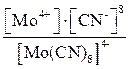 .
.
1. Ba[Pt(NO3)4Cl2] ® Ba2+ + [Pt(NO3)4Cl2]2–.
2. [Pt(NO3)4Cl2]2– D Pt4+ + 4NO3– + 2Cl–,
КН = 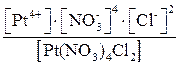 .
.
1. [Co(NH3)3(H2O)3]Cl3 ® [Co(NH3)3(H2O)3]3+ + 3Cl–.
2. [Co(NH3)3(H2O)3]3+ D Co3+ + 3NH3 + 3H2O,
КН = 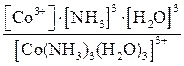 .
.
1. [Cr(H2O)3Cl3] D Cr3+ + 3H2O + 3Cl–,
КН = 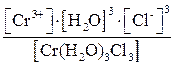 .
.
Последнее комплексное соединение относится к типу комплексных неэлектролитов, практически очень трудно разрушить его внутреннюю сферу.






