Вычислите объем кислорода (при нормальных условиях), выделившегося при получении 4,6 кг металлического натрия электролизом расплава едкого натрия.
Решение.
Схема электролиза расплава едкого натрия:
NaOH  Na+ + OH–,
Na+ + OH–,
катод (–) – Na+ + 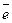 = Na0;
= Na0;
анод (+) – 4OH– – 4 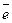 = O2 + 2H2O.
= O2 + 2H2O.
Согласно второму закону Фарадея, одинаковые количества электричества выделяют на электродах эквивалентные массы веществ. Определим, сколько эквивалентов содержится в 4,6 кг металлического натрия. Молярная масса эквивалента натрия равна 23 г/моль, следовательно, в 4,6 кг (4600 г) натрия содержится:  = 200 экв.
= 200 экв.
На аноде также выделится 200 экв. кислорода. Рассчитаем, сколько это составит литров. Объем 1 экв. кислорода равен 5,6 л, а 200 экв. кислорода:
200 × 5,6 = 1120 л.
Итак, при электролизе расплава гидроксида натрия на аноде выделится при нормальных условиях 1120 л кислорода.




