Позначимо маси компонентiв g i г; їх суму е gi; кiлькiсть молей компонентiв ni; їх суму е ni; молярнi маси Mi, г/моль; об’єм розчину V, л; еквiвалентну масу MЕi, г/моль.
1.Масова доляω i - вiдношення маси речовини до маси розчину. Якщо масова доля виражена в процентах, її називають масовими процентами, або процентною концентрацiєю:
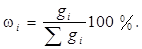
Процентна концентрацiя чисельно дорiвнює кiлькостi грамiв речовини в 100 г розчину.
2.Мольна доля Ni – вiдношення числа молей речовини до суми числа молей всiх компонентiв:
 де
де 
3.Молярна концентрацiя, або молярнiсть, дорiвнює числу молей розчиненоϊ речовини в 1 л розчину:

Розчини з молярнiстю 1 і 0,1… моль/л називаються одномолярними, децимолярними i т.п. Скорочено записують так: 1 M розчин NaOH, 0,1 M розчин HCl тощо.
4.Молярна концентрацiя еквiвалентiв (нормальнiсть) СNі – число еквiвалентiв речовини (nЕі = g / MЕі) в одному лiтрi розчину.
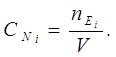
Розчини, якi мiстять в 1 л 1; 0,1… еквiвалента розчиненої речовини, називаються однонормальними, децинормальними вiдповiдно.
Згiдно з законом еквiвалентiв, речовини реагують без залишку, якщо CN I V I = CN 2 V 2. Це вiдношення використовується в об’ємному аналiзi, тобто при визначеннi концентрацiї речовини вимiрюванням об’єму реагуючих речовин.
5. Моляльнiсть, або моляльна концентрацiя - Cm i (mi), ni - число молей речовини в 1кг розчинника:

де g – маса розчинника, г; 1000 - коефіцієнт перерахунку г у кг.
6. Титр розчину по речовині (Ті) дорiвнює масi речовини, яка мiститься в 1 мл розчину:

Можна записати: 
де r – густина розчину, г/мл, а w виражена у відсотках.
Приклад 1. Розрахувати титр, нормальнiсть, моляльнiсть, мольну долю i молярну концентрацiю 20 %-го розчину HСl (r = 1,1 г/мл).
Розв’язок:
1. Т (HCl) -?
Т (HCl) = rw = 0,20 Ч 1,1 = 0,22 (г/мл).
2. CN (HCl) -?
а) T (HCl) = CN (НСl) Ч MЕ (НСl) / 1000, звiдси
CN (НСI) = Т (HCI)1000 / MЕ (НСІ) = 0,22 Ч 1000/36,5 = 6,03 моль/л;
б) 1 л 20 %-го розчину має масу 1000 Ч 1,1 = 1100 г, в ньому мiститься. 1100 . 20 / 100 = 220 г HClабо 220 / 36,5 = 6,03 еквiвалента HCl, тобто CN HCl = = 6,03 моль/л.
3. Сm (HCl) -?
На 80 г води припадає 20 г НCl, або 20 / 36,5 моль HCl, звідси моляльна концентрацiя розраховується згідно з формулою:
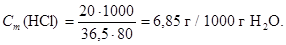
4. C N (HCl) -?
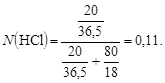
5. CM (HCl) -?


Відповідь: Т (HCl) = 0,22 (г/мл), CN (HCl) = 6,03 моль/л; CM (HCl) = = 6,03 моль/л; Сm (HCl) = 6,85 г/1000 г Н2О; N (HCl) = 0,11.
Приклад 2. Скiльки мiлiлiтрiв 12 %-го розчину натрiй гідроксиду (r = = 1,135 г/мл) потрiбно для приготування 210 мл 4,5 %-го розчину NaOH (r = = 1,05 г/мл)?
Розв’язок:
1. m (210 мл розчину NaOH) -?
m = Vr = 210 мл . 1,05 г/мл = 220,5 г
2. m (NaOH) у 220,5 г розчину -?
100 г розчину - 4,5 г NaOH;
220,5 г розчину - х г NaOH;
х = (220,5 Ч 4,5)/100 = 9,9 г NaOH.у
3. m (12 %-го розчину NaOH), необхiдна для приготування кінцевого розчину -?
100 г 12 %-го розчину – 12 г NaOH;
x г 12 %-го розчину - 9,9 г NaOH;
x = (100 Ч 9,9)/12 = 82,8 г 12 %-го розчину NaOH.
4. V (12 %-го розчину NaOH), необхiдний для приготування кінцевого розчину -?
V = m /r = 82,5 / 1,135 = 71,7 (мл).
Відповідь: для приготування кінцевого розчину необхідно 71,7 мл вихідного розчину.






