В различных пищевых технологиях долгое время применялись лишь препараты свободных ферментов, срок использования которых — один производственный цикл. Однако достижения молекулярной биологии, биохимии и энзимологии привели к тому, что в настоящее время строение и функции многих ферментов изучены очень детально и это позволило создать теоретическую базу для производства ферментов пролонгированного действия или иммобилизованных ферментов, т. е. фиксированных или связанных ферментных препаратов.
Сущность иммобилизации ферментов заключается в присоединении их в активной форме тем или иным способом к инертной матрице (обычно это нерастворимый полимерный носитель).
Иммобилизацию фермента можно определить и как включение молекулы фермента в какую-либо изолированную фазу, которая отделена от фазы свободного раствора, но способна обмениваться находящимися в ней молекулами субстрата, эффектора или кофактора.
Фаза фермента обычно нерастворима в воде и часто представляет собой высокомолекулярный гидрофильный полимер, например, целлюлозу, полиакриламид, сефарозу и т. п.
Принципы и способы иммобилизации. Включение фермента в изолированную фазу осуществляют различными способами: фермент может быть ко валентно связан с этой фазой, адсорбирован на ней или физически включен в нее.
Возможны следующие способы иммобилизации фермента.
1. Ковалентное связывание. Молекула фермента ковалентно связывается с нерастворимым полимером. Полимер может быть в виде порошка или в форме пленки. Иногда молекулы фермента соединяются ковалентными связями друг с другом или с каким-либо инертным белком; при этом образуется нерастворимый, но активный полимерный фермент (рис. 8.11).
2. Электростатическое связывание. Этот способ иммобилизации основан на использовании электростатических или других нековалентных механизмов связывания (рис. 8.12).
3. Сополимеризация с помощью многофункциональных реагентов. Связывание молекул фермента с белками (например, с альбумином) или друг с другом осуществляется за счет использования определенных реагентов. В качестве такого многофункционального реагента часто используют глутаровый альдегид, гелеобразующее действие которого известно давно. В этом способе необходимо избегать взаимодействия реагента с активным центром фермента и ингибирования последнего (рис. 8.13).

Рис. 8.11. Ковалентное связывание
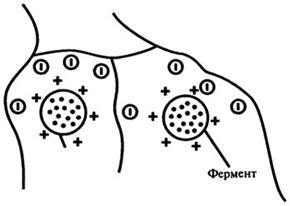
Рис. 8.12. Электростатическое связывание (адсорбция)

Рис. 8.13. Поперечное сшивание молекул фермента
4. Включение в полимер. В этом способе фермент не прикреплен к полимеру, но удерживается внутри него, поскольку последний образует вокруг фермента сетеобразную матрицу (рис. 8.14). Ячейки этой матрицы настолько малы, что молекула фермента не может освободиться из сети, но в то же время достаточно велики для проникновения низкомолекулярных субстратов. Примером такого способа иммобилизации могут служить:
а) включение в липосомы, когда фермент находится в водном растворе, окруженном фосфолипидным барьером (рис. 8.15);
б) гидрофобное взаимодействие, когда фермент "погружен" в гидрофобную часть двойного липидного слоя (рис. 8.16).

Рис. 8.14. Включение в полимер

Рис. 8.15. Включение в липосомы
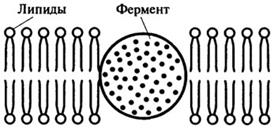
Рис. 8.16. Гидрофобное взаимодействие
5. Инкапсулирование. Включение фермента в органическую или неорганическую капсулу, которая представляет собой полупроницаемую мембрану (рис. 8.17).
Выбор способа иммобилизации. Искусство иммобилизации ферментов заключается в правильном выборе подходящего метода. Этот выбор определяется целым рядом факторов, многие из которых невозможно выявить до тех пор, пока метод не будет опробован.
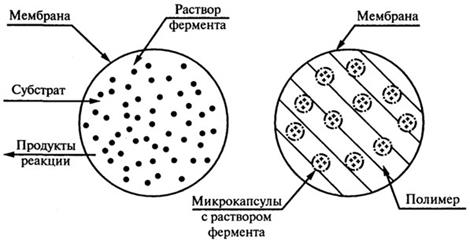
Рис. 8.17. Получение микрокапсул
Первичный отбор осуществляется обычно эмпирическим путем. Сначала нужно решить, необходим ли для прикрепления фермента какой-либо специфический носитель, не будет ли процедура иммобилизации инактивировать фермент и сможет ли иммобилизованный фермент действительно функционировать в тех условиях, при которых его предстоит использовать.
Поэтому для успешной иммобилизации следует по возможности принять во внимание следующие факторы:
— фермент должен быть стабильным в условиях протекания реакции;
— реагенты, образующие поперечные сшивки, не должны взаимодействовать с химическими группировками активного центра. В связи с этим поперечно-сшивающий реагент должен быть как можно больших размеров, что будет препятствовать его проникновению в активный центр;
— всегда, когда это осуществимо, необходимо тем или иным способом защищать активный центр фермента (например, обработка тиоловых ферментов глутатионом или цистеином);
— процедура промывания для удаления "непришитого" фермента не должна оказывать вредного влияния на иммобилизованный фермент;
— полимерная матрица не должна являться субстратом для иммобилизованного фермента;
— необходимо, наконец, учитывать механические свойства носителя, особенно его механическую прочность и физическую форму.
Процесс иммобилизации фермента можно продемонстрировать на примере связывания глюкоамилазы с носителем — ацетил этил целлюлозой.
Носитель выдерживают сутки в дистиллированной воде для набухания. Далее к набухшей ацетилэтилцеллюлозе добавляют сначала натрий-ацетатный буфер с рН 5,5, а затем раствор очищенного фермента; после перемешивания к смеси добавляют поперечно-сшивающий агент — глутаровый альдегид. Через несколько часов полученный препарат промывают последовательно натрий-ацетатным буфером и раствором хлористого натрия для удаления несорбированного на носителе фермента. Иммобилизованный таким образом фермент хранится под слоем воды или буфера при 3 — 5°С.
В настоящее время разработаны методы иммобилизации множества ферментов. Один и тот же фермент можно иммобилизировать несколькими методами. Например, глюкозоизомеразу из S. phaeochromogenes можно иммобилизовать на различных носителях: пористом алюминии, ДЭАЭ-целлюлозе, ДЭАЭ-крахмале и др. Лактатдегидрогеназу можно включить в гель, прикрепить к носителю поперечной сшивкой; аспарагиназу — прикрепить к носителю сорбционным путем или химической (ковалентной) связью. В табл. 8.4 представлены некоторые методы иммобилизации для различных ферментов.
Влияние иммобилизации на ферментативную активность. Иммобилизация часто приводит к резким изменениям основных параметров ферментативной реакции: максимальной скорости (Vmax); константы Михаэлиса (Кт); оптимума рН и температуры, а также отношения к ингибиторам.
Степень и природа этих изменений зависят не только от используемого метода иммобилизации, но и от типа ферментативной реакции. Большое влияние на ферментативную активность может оказывать полимерная матрица, причем это влияние может проявляться как в виде воздействия на микроокружение фермента, так и непосредственно на саму молекулу фермента. Кроме того, сами условия иммобилизации (значение рН, присутствие свободных радикалов, окисляющих агентов и т. п.) могут приводить к частичной или полной инактивации фермента.
При рассмотрении влияния иммобилизации на ферментативную активность одним из важных является вопрос об эффективных кинетических параметрах.
Параметры Кт и Vmax, используемые для характеристики каталитических свойств ферментов в разбавленных растворах (см. разд. 8.2), не могут быть применены в их строгом математическом значении для характеристики иммобилизованных ферментов, т. к. наблюдаются существенные отклонения от гиперболической субстратной кривой, описываемой уравнением Михаэлиса — Ментен, и искривления прямолинейных графиков в двойных обратных координатах (уравнение Лайнуивера — Берка).
Таблица 8.4. Иммобилизация некоторых ферментов известными методами [М. Е. Бекер. Введение в биотехнологию, 1978]
| Метод иммобилизации | Шифр фермента | Наименование |
| Адсорбция или ионный обмен | 1.11.1.6 | Каталаза |
| 3.2.1.21 | β-Глюкозидаза | |
| 3.2.1.26 | Инвертаза | |
| 3.4.23.1 | Пепсин | |
| 3.4.21.4 | Трипсин | |
| Влючение в гель (полиакриламидный) | 3.5.1.1 | Аспарагиназа |
| 1.1.1.27 | Лактатдегидрогеназа | |
| 1.1.3.4 | Глюкозооксидаза | |
| 1.11.1.7 | Пероксидаза | |
| 3.2.1.1 | α-амилаза | |
| 3.2.1.2 | β-Амилаза | |
| Поперечная пришивка фермента к носителю | 3.2.21.4 | Трипсин |
| Прикрепление фермента к носителю ковалентной связью | 1.1.1.27 | Лактатдегидрогеназа |
| 1.1.3.4 | Глюкозооксидаза | |
| Азидным методом | 1.11.1.7 | Пероксидаза |
| 3.4.21.4 | Трипсин | |
| Карбоимидным методом | 3.2.1.26 | Инвертаза |
| 3.4.21.4 | Трипсин | |
| 3.5.1.1 | Аспарагиназа | |
| Бромциан-методом | 1.1.3.4 | Глюкозооксидаза |
| 1.11.1.7 | Пероксидаза | |
| 3.4.21.4 | Трипсин | |
| Методом диазотирования | 3.1.1.7 | Ацетилхолинэстераза |
| 3.1.1.8 | Холинэстераза | |
| 3.5.1.1 | Аспарагиназа | |
| 1.1.3.4 | Глюкозооксидаза | |
| Изотиоциатный метод | 1.11.1.6 | Каталаза |
| 1.11.1.7 | Пероксидаза | |
| 3.2.1.1 | α-амилаза | |
| 3.4.21.4 | Трипсин | |
| 3.2.1.2 | β-Амилаза |
По этой причине в случае иммобилизованных ферментов лучше заново определить физический смысл данных кинетических параметров. Ранее с этой целью использовался параметр "кажущаяся" Кm, но позднее было предложено пользоваться двумя константами: Kw и Vs.
Vs — самая высокая скорость, которую можно достичь (теоретически) в данной системе, т. е. когда фермент полностью насыщен субстратом. Следовательно, этот параметр отражает исходные свойства иммобилизованного фермента, но на него могут влиять диффузионные ограничения.
Kw — такая концентрация субстрата, при которой скорость реакции равна Vs/2. Этот параметр отражает реальные свойства субстрата и зависит от эффекта распределения и диффузионных ограничений.
Величина Кm (кажущаяся) не может отражать истинного положения, т. к. варьирует в зависимости от выбранного диапазона концентраций субстрата. Например, ограничение диффузии субстрата сильнее проявляется при низких концентрациях субстрата, а эффект распределения более выражен при низких ионных силах. От этих двух факторов зависит видимая легкость связывания фермента с субстратом, и поэтому они оказывают существенное влияние на параметр Кm (кажущаяся).
Необходимо также учитывать и возникновение кооперативных эффектов в поведении иммобилизованных ферментов в ответ на изменение концентрации субстрата. Иммобилизованные ферменты (в отличие от аллостерических, которые проявляют или только положительную, или только отрицательную кооперативность) способны обнаруживать оба вида кооперативности в зависимости от рН и микроокружения. Кооперативные эффекты имеют важное значение, т. к. позволяют выявить как значительные изменения скорости реакций в небольшом диапазоне концентраций субстрата, так и малые изменения скорости реакции в других, очень широких диапазонах концентраций субстрата.
Применение иммобилизованных ферментов. Иммобилизованные ферменты как катализаторы многоразового действия можно использовать, в основном, для трех практических целей: аналитических, лечебных и препаративных.
При решении вопроса о целесообразности использования системы с иммобилизованным ферментом следует руководствоваться следующими критериями: эффективностью, стоимостью и возможностью осуществить процесс с помощью другой системы.
В случае препаративного (промышленного) применения основную роль играет стоимость, а также возможность автоматизации процесса. Несмотря на большие потенциальные возможности использования иммобилизованных ферментов в производстве, в настоящее время реализованы лишь немногие, например:
— разделение D- и L-аминокислот, основанное на использовании плесневой аминоацилазы (Н. Ф. 3.5.1.14), иммобилизованной на ДЭАЭ-сефадексе;
— получение сиропов с высоким содержанием фруктозы с использованием глюкозоизомеразы (Н.Ф.5.3.1.18), иммобилизованной на целлюлозном ионообменнике;
— возможно использование иммобилизованных ферментов при производстве сыров, стабилизации молока и удалении лактозы из молочных продуктов.






