1. Укажите, какие из приведенных процессов представляют собой окисление и какие – восстановление:

2. Расставьте коэффициенты в уравнениях следующих реакций:


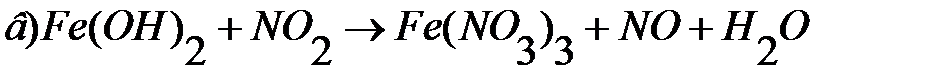


3. Закончите уравнения реакций и расставьте коэффициенты:



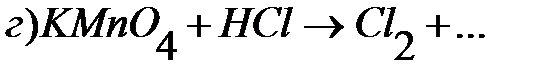
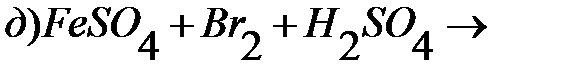
Тестовые задания для самостоятельного решения.
Выбрать один правильный ответ.
001.ЭКВИВАЛЕНТНАЯ МАССА СЕРНИСТОЙ КИСЛОТЫ, В РЕАКЦИИ ПОЛНОГО ОБМЕНА, РАВНА
1) 41 г/моль
2) 49 г/моль
3) 82 г/моль
4) 98 г/моль
5) 34 г/моль
002. В ПPИВЕДЕННОЙ ЭЛЕКТPОННО-ИОННОЙ СХЕМЕ ЧИСЛО ПPИНЯТЫХ ИЛИ ОТДАННЫХ ЭЛЕКТPОНОВ, НАЙДЕННОЕ ПО ПPАВИЛУ СУММЫ ЗАPЯДОВ РАВНО
 :
:
1) +6e
2) –2e
3) +14e
4) - 6e
5) - 14e
003. ТИП ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЙ РЕАКЦИИ

1) межмолекуляpное окисление-восстановление;
2) диспpопоpциониpование;
3) внутpимолекуляpное окисление-восстановление
4) реакция нейтрализации
5) реакция осаждения
004. ОБА ВЕЩЕСТВА ПPОЯВЛЯЮТ ТОЛЬКО ОКИСЛИТЕЛЬНЫЕ СВОЙСТВА:
1) KMnO4 и CrO3
2) SO2 и N2O5;
3) S и HNO3
4) H2O2 и K2Cr2O7
5) нет верного ответа
005. ТИПИЧНЫЙ ОКИСЛИТЕЛЬ
1) Ba(NO2)2
2) NO2
3) HNO3
4) Ca3N2
5) Н2О2
006. СОСТАВЬТЕ УРАВНЕНИЕ ОВР ИОННО-ЭЛЕКТРОННЫМ МЕТОДОМ И УКАЗАТЬ СУММУ КОЭФФИЦИЕНТОВ У ОКИСЛИТЕЛЯ И ВОССТАНОВИТЕЛЯ
 .
.
1) 6
2) 13
3) 7
4) 14
5) 5
007. ПРОЦЕСС, ПРОТЕКАЮЩИЙ В СИСТЕМЕ 
1) окисление
2) восстановление
3) диспропорционирование
4) реакция нейтрализации
5) реакция осаждения
Занятие №7
«РАВНОВЕСИЯ КОМПЛЕКСООБРАЗОВАНИЯ И ИХ РОЛЬ В АНАЛИТИЧЕСКОЙ ХИМИИ»
Вопросы к занятию:
- Координационная теория А.Вернера и ее развитие Л.А.Чугаевым.
- Понятие о координационном числе, комплексообразователе и лигандах.
- Классификация и номенклатура комплексных соединений. Внутрикомплексные соединения.
- Понятие об изомерии комплексных соединений и ее типы.
- Природа химической связи в комплексных соединениях в свете метода валентных связей.
- Факторы, влияющие на комплексообразующую способность d-элементов.
- Ионные равновесия в растворах комплексных соединений. Константа нестойкости комплекса.
- Значение комплексных соединений в биологии и медицине.
§1.Строение комплексных соединений. Основные положения теории Вернера о строении комплексных соединений
Многие процессы жизнедеятельности организма протекают с участием комплексных соединений. В живых организмах присутствуют комплексные соединения биогенных металлов с белками, витаминами и другими веществами, играющими роль ферментов или выполняющими специфические функции в обмене веществ.
В CICв. в химии было накоплено большое число фактов, необъяснимых с точки зрения существовавшей тогда теории валентности. Многие вещества, в которых элементы, казалось бы, уже полностью использовали свои валентности, сохраняли способность к дальнейшему присоединению различных ионов и молекул. При этом новые, «незаконные» (с точки зрения теории валентности) связи оказывались не менее прочными, чем «обычные» валентные связи. Некоторые из вновь открытых соединений были названы двойными солями (например, 3КF·AlF3), другие – аммиакатами, (например CuSO4·4NH3), третьи – кристаллогидратами (CuCl2∙·6H2O) и т. д.
Крупнейший русский химик Лев Александрович Чугаев, получивший мировое признание за работы по химии комплексных соединений, писал, что эта область «по своей запутанности, по противоречивости фактических данных и отсутствию какой-либо общей руководящей идеи казалась совершенно безнадежной для систематической разработки».
Такой «общей руководящей идеей» стала разработанная к 1893 г. швейцарским химиком Альфредом Вернером теория строения комплексных (или координационных) соединений
Вернер разделил все неорганические вещества на так называемые соединения первого и высшего порядка. К соединениям первого порядка он отнес главным образом достаточно простые по своей структуре вещества (H2O, NaCl, PCl3). Соединениями высшего порядка ученый предложил считать продукты взаимодействия между собой соединений первого порядка – кристаллогидраты, аммиакаты, полисульфиды, двойные соли, а также комплексные соединения.
Комплексное соединение, по Вернеру, имеет в своей структуре центральный атом (ион), названный комплексообразователем, который равномерно окружен различными ионами или нейтральными молекулами. Комплексообразователь (центральный атом) – атом или ион, предоставляя свободные атомные орбитали, является акцептором электронных пар и занимает центральное положение в комплексном соединении.
Молекулы или ионы, которые окружают комплексообразователь, позднее названные лигандами (от лат. ligare – «связывать») являются донорами электронных пар и непосредственно связанны с центральным атомом (ионом) ковалентной связью, образованной по донорно-акцепторному механизму.
Роль комплексообразователя может играть любой элемент периодической системы. В соответствии со своей химической природой неметаллические элементы обычно дают анионные комплексы, в которых роль лигандов играют атомы наиболее электроотрицательных элементов. Типичные металлические элементы (щелочные и щелочноземельные металлы) проявляют слабую способность к комплексообразованию. Амфотерные элементы, которые занимают промежуточное положение между типичными металлическими и неметаллическими элементами, образуют как катионные, так и анионные комплексные соединения, например [Al(H2O)6]Cl3 и K[Al(OH)4]. Наиболее выраженную способность к комплексообразованию проявляют атомы или ионы d-, и f-элементов, так как они имеют достаточно большой заряд ядра и способны предоставлять необходимое количество вакантных орбиталей для образования связей с лигандами.
Число донорных атомов лигандов, непосредственно связанных с центральным атомом, называется его координационным числом. Значениекоординационного числа комплексообразователя зависит от многих факторов, но обычно оно равно удвоенному заряду иона комплексообразователя.
Вернер предложил в каждом комплексном соединении различать две координационные сферы: внутреннюю и внешнюю. Внутренняя сфера комплексного соединения есть совокупность центрального атома и лигандов. При записи состава комплексных соединений принято центральный атом вместе со всеми ионами и молекулами, входящими во внутреннюю сферу, заключать в квадратные скобки. Вне скобок остаются лишь ионы внешней сферы, нейтрализующие заряд комплексного иона; в ряде комплексных соединений внешняя сфера может отсутствовать. Ионы внешней сферы связаны с комплексным ионом посредством ионной связи.
Именно внешние ионы при растворении комплексного соединения в воде легко отщепляются и находятся в растворе самостоятельно, обуславливая (совместно с комплексным ионом) его электропроводность. Лиганды внутренней координационной сферы связаны с центральным атомом настолько прочно, что, по меткому выражению Вернера, словно «исчезают» внутри комплекса, не проявляя себя ни в аналитических реакциях, ни в электропроводности раствора. Именно поэтому, комплексными Вернер назвал соединения, устойчивые в растворах и не проявляющие свойств исходных для них соединений первого порядка. (рисунок 8.1)
Рисунок 8.1
Общее строение комплексных соединений.
центральный атом
(комплексообразователь) лиганды
[Cu(NH3)4(H2O)2]SO4
внутренняя сфера ионы внешней сферы
§2. Классификация комплексных соединений
По характеру электрического заряда комплексного иона различают катионные, анионные и нейтральные комплексные соединения.
Заряд комплексного иона определяется алгебраической суммой зарядов комплексообразователя и всех лигандов.
Например, комплексный ион [Cu+2(NH3)4]z, z = +2 + 4∙0 = +2, то есть [Cu+2(NH3)4]2+.
Внутренняя сфера может быть:
А) заряжена положительно – такие комплексы называют катионными:
[Al(H2O)6]Cl3 – хлорид гексаакваалюминия (ІІІ),
[Zn(NH3)4]SO4 –сульфат тетраамминцинка (ІІ).
Катионные комплексы образованы положительно заряженным комплексообразователем и нейтральными лигандами.
Б) заряжена отрицательно – комплексы называют анионные:
K2[BeF4] – тетрафторобериллат (ІІ) калия,
Na3[Fe(CN)6] – гексацианоферрат (ІІІ) натрия.
В роли комплексообразователя в анионном комплексе выступает положительно заряженный ион, а лигандами являются атомы с отрицательной степенью окисления.
В) электронейтральные:
[Pt(NH3)4Cl2] – дихлородиамминплатина (ІІ),
[Ni(CO)4] – тетракарбонилникеля
Нейтральные комплексы образуются при координации вокруг атома молекул, а также при одновременной координации вокруг положительно заряженного комплексообразователя отрицательных ионов и молекул.
По природе входящих в комплексный ион лигандов комплексные соединения могут быть классифицированы следующим образом: если в составе комплексного иона лиганды молекулы аммиака, то такие комплексы называются аммиакатами, например [Cu(NH3)4]SO4 – сульфат тетраамминмеди (ІІ); лиганды молекулы воды – аквакомплексы ил гидраты: [Cr(H2O)6]Br3 – бромид гексааквахрома (ІІІ); лиганды представлены остатками кислот – ацидокомплексы: K2[Be(SO4)2] – дисульфатобериллат (ІІ) калия.
Лиганды могут занимать в координационной сфере одно или несколько мест, т.е. образовывать одну или несколько связей с комплексообразователем. Это свойство лигандов получило название – дентантность. По этому признаку различают моно-, би-, полидентантные комплексные соединения.
Примерами монодентантных лигандов являются ионы Cl–, OH–, Br–, молекулы H2O, NH3, CO и др.
Структуру монодентантного комплексного иона [Cu(NH3)4]+2 можно представить следующим образом:

К бидентантным комплексным соединениям относится (бис) этилендиамминмеди (ІІ):
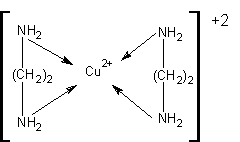
Известно множество полидентантных лигандов, которые могут занимать сразу несколько координационных мест. Если они координируются одним и тем же центральным атомом, образуются комплексы, которые называются хелатными (от греч. «хеле» – «клешня»). В хелатных комплексах лиганды как бы обхватывают центральный атом, подобно клешням краба. Так, диметилглиоксим (реактив Чугаева) служит аналитическим реагентом на никель: он образует с ионами Ni+2 малиново-красный хелатный комплекс:

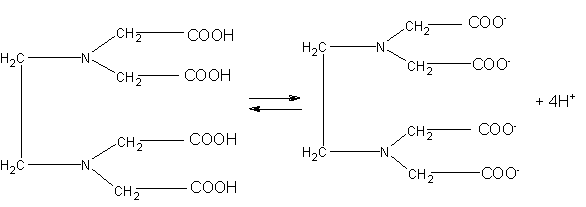
К полидентантным комплексным соединениям относится этилендиаминтетрауксусная кислота (EDTA) или другое ее название –
Трилон А: