Выбрать один правильный ответ.
001.В СОСТАВ БУФЕРНЫХ РАСТВОРОВ ВХОДЯТ КОМПОНЕНТЫ:
1) сильная кислота и сильное основание
2) слабая кислота и слабое основание
3) слабая кислота и её соль с сильным основанием
4) сильное основание и его соль с слабой кислотой
002. БУФЕРНЫМИ РАСТВОРАМИ НАЗЫВАЮТ -
1) растворы, имеющие одинаковое осмотическое давление
2) растворы, сохраняющие рН примерно постоянным при добавлении кислоты, щелочи или разбавлении
3) растворы, содержащие кислотно-основную сопряженную пару
4) растворы, имеющие одинаковые температуры кипения и замерзания
003. ВЫРАЖЕНИЕ УРАВНЕНИЯ ГЕНДЕРСОНА-ГАССЕЛЬБАХА ДЛЯ АММИАЧНОГО БУФЕРНОГО РАСТВОРА РАВНО:
1) рН = 14 – рКВ – lg (Ссоль/ Соснование);
2) рН = 14 + рКВ + lg (Ссоль/ Соснование);
3) рН = 7 – рКВ – lg (Ссоль/ Соснование);
4) рН = 7 + рКВ + lg (Соснование/ Ссоль).
004. АЦЕТАТНАЯ БУФЕРНАЯ СИСТЕМА ОТНОСИТСЯ К ГРУППЕ:
1) слабое основание и его катион;
2) средняя и кислая соль;
3) раствор амфолитов;
4) слабая кислота и ее соль
005. рН БУФЕРНОЙ СИСТЕМЫ, СОСТОЯЩЕЙ ИЗ 0,001Н РАСТВОРА УКСУСНОЙ КИСЛОТЫ И 0,002Н РАСТВОРА АЦЕТАТА НАТРИЯ (КА= 2·10-5) СООТВЕТСТВУЕТ:
1) 5,0;
2) 4, 5;
3) 6,9;
4) 4,7.
006. ГЕМОГЛОБИНОВАЯ БУФЕРНАЯ СИСТЕМА ОТНОСИТСЯ:
1) слабое основание и его катион;
2) средняя и кислая соль;
3) раствор амфолитов;
4) слабая кислота и ее соль.
007. БУФЕРНАЯ ЕМКОСТЬ РАСТВОРА КИСЛОТЫ РАССЧИТЫВАЕТСЯ:
1) BНА = N (НА) / |ΔpH|;
2) BНА = N (НА) ·|ΔpH|·VРРА;
3) BНА = N(НА) ·|ΔpH|+VРРА;
4) BНА = N(НА) /ΔpH|-VРРА;
Занятие №6
«ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РАВНОВЕСИЯ»
Вопросы к занятию.
1. Понятие об окислительно-восстановительных реакциях.
2. Классификация ОВР
3. Расчет эквивалентов окислителя и восстановителя.
1. Окислительно-восстановительный потенциал.
2. Лабораторный практикум. Качественные реакции на анионы 1-3 групп.
3. Задачи для самостоятельного решения.
4. Тестовые задания для самостоятельного решения.
§1. Понятие об окислительно-восстановительных реакциях.
Окислительно-восстановительные методы объемного анализа основаны на применении окислительно-восстановительных реакций.
Окислительно-восстановительными реакциями называются такие процессы, в которых происходит переход электронов от одних молекул, атомов, ионов (восстановителей) к другим (окислителям). В результате изменяются степени окисления атомов, входящих в состав реагирующих веществ:

Окисление – это процесс отдачи электронов атомом, молекулой, ионом; степень окисления при этом повышается:

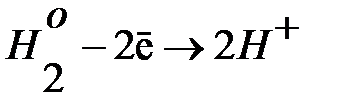

Восстановление – это процесс присоединения электронов атомом, молекулой, ионом; степень окисления при этом понижается:



Окисление всегда сопровождается восстановлением и наоборот.






