1. Электронный баланс - метод нахождения коэффициентов в уравнениях окислительно-восстановительных реакций, в котором рассматривается обмен электронами между атомами элементов, изменяющих свою степень окисления. Число электронов, отданное восстановителем равно числу электронов, получаемых окислителем.
2. Электронно-ионный баланс (метод полуреакций) метод нахождения коэффициентов, в котором рассматривается обмен электронами между ионами в растворе с учетом характера среды:
| 2Cl1- – 2ē ® | Cl20 | 5 | |
| MnO41- + 8H+ | + 5ē ® | Mn2+ + 4H2O | 2 |
| 7+ | 2+ |
–––––––––––––––––––––––––––
10Cl- + 2MnO41- + 16H+ ® 5Cl20 + 2Mn2+ + 8H2O
(для уравнивания ионной полуреакции используют H+, OH- или воду)
Типичные реакции окисления-восстановления.
1.Реакции с участием перманганата калия в качестве окислителя.
При взаимодействии перманганата калия с восстановителем образуются различные продукты восстановления в зависимости от pH среды.
Реакции в кислой среде.
5K2S+4O3 + 2KMn+7O4 + 3H2SO4 ® 6K2S+6O4 + 2Mn+2SO4 + 3H2O
| MnO4- + 8H+ + 5ē ® Mn2+ + 4H2O | 2 |
| SO32- + H2O – 2ē ® SO42- + 2H+ | 5 |
–––––––––––––––––––––––––––––––––
2MnO4- + 16H+ + 5SO32- + 5H2O ® 2Mn2+ + 8H2O + 5SO42- + 10H+
или 2MnO4- + 6H+ + 5SO32- ® 2Mn2+ + 3H2O + 5SO42-
Реакции в нейтральной среде
3K2S+4O3 + 2KMn+7O4 + H2O ® 3K2S+6O4 +2Mn+4O2¯ + 2KOH
| MnO41- + 2H2O + 3ē ® MnO2 + 4OH- | 2 | |
| SO32- + 2OH- - 2ē ® SO42- + H2O | 3 | |
–––––––––––––––––––––––––––––––––––
2MnO4- + 4H2O + 3SO32- + 6OH- ® 2MnO2 + 8OH- + 3SO42- + 3H2O
или 2MnO4- + H2O + 3SO32- ® 2MnO2 + 2OH- + 3SO42-
Реакции в щелочной среде.
K2S+4O3 + 2KMn+7O4 + 2KOH ® K2S+6O4 +2K2Mn+6O4 + H2O
| SO32- + 2OH- - 2ē ® SO42- + H2O | 1 |
| MnO41- + ē ® MnO42- | 2 |
–––––––––––––––––––––––––––––––––
SO32- + 2OH- + 2MnO4- ® SO42- + H2O + 2MnO42-
2.Реакции с дихроматом калия в качестве окислителя
Степень окисления хрома понижается с +6 до +3.
1.
K2Cr2+6O7 + 3H2S-2 + 4H2SO4 ® K2SO4 + Cr2+3(SO4)3 + 3S0¯ + 7H2O
| Cr2O72- + 14H+ + 6ē ® 2Cr3+ + 7H2O | 1 | |
| H2S0 - 2ē ® S0 + 2H+ | 3 | |
––––––––––––––––––––––––––––––––––
Cr2O72- + 8H+ + 3H2S ® 2Cr3+ + 7H2O + 3S0
2.
K2Cr2+6O7 + 6Fe+2SO4 + 7H2SO4 ® 3Fe2+3(SO4)3 + K2SO4 + Cr2+3(SO4)3 + 7H2O
| Cr2O72- + 14H+ + 6ē ® 2Cr3+ + 7H2O | 1 |
| Fe2+ - ē ® Fe3+ | 6 |
–––––––––––––––––––––––––––––––––––––
6Fe2+ + Cr2O72- + 14H+ ® 2Cr3+ + 6Fe3+ + 7H2O
3.
K2Cr2+6O7 + 14HCl-1 ® 3Cl20 + 2KCl + 2Cr+3Cl3 + 7H2O
| Cr2O72- + 14H+ + 6ē ® 2Cr3+ + 7H2O | 1 |
| 2Cl1- - 2ē ® Cl20 | 3 |
–––––––––––––––––––––––––––––––––––
Cr2O72- + 6Cl- + 14H+ ® 2Cr3+ + 3Cl20 + 7H2O
3.Пероксид водорода в окислительно-восстановительных реакциях
Обычно пероксид водорода используют как окислитель:
H2O2 + 2HI-1 ® I20 + 2H2O
| 2I- - 2ē ® I20 | 1 |
| H2O2 + 2H+ + 2ē ® 2H2O | 1 |
––––––––––––––––––––––
2I- + H2O2 + 2H+ ® I2 + 2H2O
При действии сильных окислителей пероксид водорода может окисляться, образуя кислород и воду.
5H2O2 + 2KMn+7O4 + 3H2SO4 ® 5O20 + K2SO4 + 2Mn2+SO4 + 8H2O
| MnO4- + 8H+ + 5ē ® Mn2+ + 4H2O | 2 |
| H2O2 - 2ē ® O2 + 2H+ | 5 |
–––––––––––––––––––––––––––––––––
2MnO4- + 5H2O2 + 16H+ ® 2Mn2+ + 8H2O + 5O2 + 10H+
или 2MnO4- + 5H2O2 + 6H+ ® 2Mn2+ + 8H2O + 5O2
Лабораторная работа.
«Качественные раекции на анионы 1-3 групп»
І группа анионов.
1. Действие группового реактива на анионы І группы BaCl2.
В пять пробирок налить по 2-3 капли растворов солей анионов: S042-, S2032-, C032- и прибавить в каждую пробирку во 2 капли раствора BaCl2. К полученным осадкам прибавить при перемешивании по 3-4 капли 2М хлороводородной кислоты и сделать вывод о растворимости осадков.
РЕАКЦИИ СУЛЬФАТ-ИОНА SO42-
1. Действие ионов - Са2 +.
Са2+ + S042- СаS04
ВЫПОЛНЕНИЕ РЕАКЦИИ
К 2 -3 каплям раствора соли Na2SО4 прибавить 3 капли раствора соли Са2+. Выпавший осадок поместить на предметное стекло и рассмотреть кристаллы.
РЕАКЦИИ СУЛЬФИТ - ИОНОВ SO32-.
1. Действие окислителей (KMnO4).
5K2SO3 + 2KMnO4 + 3H2SO4 ® 6K2SO4 + 2MnSO4 + 3H2O
ВЫПОЛНЕНИЕ РЕАКЦИИ
К 2-3 каплям раствора перманганата калия прибавить 3-4 капли 1М раствора серной кислоты и по каплям добавить раствор Na2SO3 до обесвечивания реакционной смеси.
РЕАКЦИИ ТИОСУЛЬФАТ – ИОНА S2O32-
1. Реакция с HCl.
S2O32− + 2H+ → S + SO2 + H2O
ВЫПОЛНЕНИЕ РЕАКЦИИ
К 2- 3 каплям раствора тиосульфата натрия прибавить 2 капли 2 М раствора хлороводородной кислоты. Написать, что наблюдается и уравнение реакции.
2.Действие окислителей
2S2O32− + I2 → S4O62− + 2I−
ВЫПОЛНЕНИЕ РЕАКЦИИ
В одну пробирку к 2-3 каплям раствора I2 прибавить 2-3 капли раствора тиосульфата натрия, в другую пробирку также к 2-3 каплям раствора перманганата калия прибавить 2 капли 1 М раствора серной кислоты и 3-4 капли раствора тиосульфата натрия. Опишите наблюдения и составьте уравнения реакций.
3. Реакция с AgNO3.
Ag+ + 2S2O32− → [Ag(S2O3)2]3−
ВЫПОЛНЕНИЕ РЕАКЦИИ
К 3 каплям раствора нитрата серебра прибавить 2 кали раствора тиосульфата натрия до образования осадка, а затем добавить избыток того же тиосульфата до растворения осадка.
РЕАКЦИИ КАРБОНАТ – ИОНА CO32 --.
1, Реакции с кислотами.
Na2C03+2HCl=2NaCl+H20+CO2
ВЫПОЛНЕНИЕ РЕАКЦИИ
В пробирку с газоотводной трубки поместить 10 капель раствора Na2C03 и равный объем 2М раствора HCl. Выделившейся газ пропустить через газоотводную трубку в другую пробирку с известковой водой. Что наблюдается?
2.Реакция с AgN03.
AgN03 + Na2C03 = 2NaN03 + Ag2C03
ВЫПОЛНЕНИЕ РЕАКЦИИ
К 2-3 каплям раствора карбоната натрия прибавить 2 капли раствора нитрата серебра. Полученный осадок исследвать на растворимость в азотной кислоте.
РЕАКЦИИ ФОСФАТ – ИОНЫ P043-.
1. Реакция с магнезильной смесью. (MgCl2 + NH40 H + NH4 Cl). Реакция фармокопейная.
Реакция протекает по уравнению:
Na2HP04 + MgCl2 + NH40H ↔ MgNH4P04 ↓ + 2 NaCl + H20
ВЫПОЛНЕНИЕ РЕАКЦИИ
К 2 -3 каплям раствора MgCl2 прибавить 2-3 капли раствора NH40H, образовавшийся осадок Mg(0H)2 растворить в NH4Cl прибавляя его по каплям. Полученную смесь нагреть на водяной бане и прибавить раствор Na2HPO4 до получения осадка. Что наблюдается?
2. Действие молибденовой жидкости (смесь (NH4)2 Mo04 c HN03)
При реакции данного реактива с фосфат – ионами образуется желтый кристаллический осадок фосформолибдата аммония.
Na3P04 + 3 NH4Cl +12(NH4)2Mo04 + 24HN03 → (NH4)3H4[P(Mo207)6↓ +
24 NH4N03 + + 3 NACl + 10 H2O
ВЫПОЛНЕНИЕ РЕАКЦИИ
К 5 каплям подогретой молибденовой жидкости постепенно при перемешивании добавить 2 капли раствора фосфата и гидрофосфата натрия.
ІІ группа анионов.
1.Действие группового реактива на анионы II группы AgNO3
Нитрат серебра осаждает анионы II группы в виде галогенидов серебра AgCl – белого цвета, AgBr – желтовато – белого цвета, AgI – желтого цвета. Осадки не раствораяются в азотной кислоте. Хорошо растворяется в концентрированном растворе аммиака AgCl с образованием белого комплекса диамина серебра [Ag(NH3)2]Cl. AgBr с трудом растворяется в аммиаке, а AgI вообще не растворяется в аммиаке.
ВЫПОЛНЕНИЕ РЕАКЦИИ
В три пробирки поместить по 3-4 капли растворов NaCl, KBr иК1, прибавить по 3 капли раствора нитрата серебра. Выпавшие осадки испытать на растворимость в азотной кислоте и в концентрированном аммиаке. Написать уравнения реакций.
РЕАКЦИИ ХЛОРИД-ИОНА.
1 Действие окислителей.
Сильные окислители (КМп04,К2Сг207,КС103, Мп02) в кислой среде окисляют ионы С1- до свободного хлора С12:
2 KCI + MnO2 + 2 H2SO4 → Сl2 ↑ + K2S04 +MnS04 + 2 H2O
Выделение хлора можно обнаружить по запаху или по посинению иодкрахмальной бумажки.
ВЫПОЛНЕНИЕ РЕАКЦИИ
К 5 каплям раствора КСl прибавить 3 капли конц. серной кислоты, немного твердого Мп02 и нагреть под тягой. Определить C12 помощью иодкрахмальной бумажки.
РЕАКЦИИ БРОМИД-ИОНА.
I. Действие окислителей.
Окислители – КМп04,Мп02, С12 и др.в кислой среде способны окислять бромид- ионы до свободного брома, который хорошо растворяется в хлороформе, окрашивая его в оранжевый цвет. Реакция фармакопейная.
С12 + 2 Вг- → 2 С1- + Вг2
ВЫПОЛНЕНИЕ РЕАКЦИИ
К 5 каплям раствора бромида натрия прибавить 1мл хлороформа,
2 капли 2М серной кислоты и затем по каплям, при встряхивании,2-3 капли хлорной воды. Наблюдается окрашивание слоя хлороформа.
Выделение свободного брома можно также обнаружить по реакции с флюоресцеином, который, взаимодействуя с парами брома, превращается в тетра – бромфлюоресцеин (эозин) красного цвета.
РЕАКЦИИ ИОДИД - ИОНА.
1.Действие окислителей. Реакция фармакопейная.
Окислители легче, окисляют иодид-ионы до свободного иода, чем хлорид и бромид- ионы, что облегчает определение иодид - иона в присутствии других галогенидов. Чаще всего, в этом случае для окисления используют хлорную воду. В первую очередь окисляются I- - ионы и свободный I2 окрашивает слой органического растворителя (бензол, толуол) в малиновый цвет.
ВЫПОЛНЕНИЕ РЕАКЦИИ
К 3 каплям раствора иодида калия прибавить 4 капли 2М раствора серной кислоты, 6 капель органического растворителя и по каплям при интенсивном встряхивании хлорную воду. Наблюдать окрашивание раствора
Написать уравнения реакции
2. Реакции с солями свинца Нитрат или ацетат свинца (II) из растворов иодида осаждает желтый иодид свинца, который хорошо растворяется в горячей воде. При охлаждении полученного раствора Рbl2 выделяется в виде золотистых чешуек.
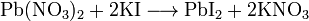
ВЫПОЛНЕНИЕ РЕАКЦИИ
К 5 каплям раствора иодита калия прибавить столько же раствора соли свинца(II). К образующемуся желтому осадку прибавить около 2 мл воды,3 капли уксусной кислоты и нагреть смесь до полного растворения осадка. Полученный раствор охладить и наблюдать выпадение золотистых чешуек иодида свинца. Написатъ уравнение реакции.
Ш группа анионов.
В отличии от анионов 1 и II группы, анионы Ш группы с катионами серебра и бария образуют растворимые в воде соли. Группового реактива для анионов третьей группы нет.
РЕАКЦИИ НИТРАТ - ИОНОВ.
1. Действие дифениламина (C6Н5)2NH. Реакция фармокопейная.
Дифениламин в кислой среде окисляется N03- ионами до хиноидного соединения синего цвета. Нитрит - ионы NO-2, ионы хромата –Сr042- и некоторые другие окислители также дают синее окрашивание, что надо иметь в виду при разделении смесей анионов.

ВЫПОЛНЕНИЕ РЕАКЦИИ
К 3-4 каплям дифениламина в концентрированной серной кислоте прибавить 1-2 капли раствора нитрата.
РЕАКЦИИ АЦЕТАТ - ИОНОВ (СН3СОО-)
1.Действие сильных кислот.
При действии сильных кислот на соли уксусной кислоты выделяется свободная уксусная кислота, обладающая характерным запахом.
ВЫПОЛНЕНИЕ РЕАКЦИИ
В пробирку поместить 5 капель раствора ацетата натрия и столько же капель 1 М серной кислоты, перемешать и слегка подогреть. Образование уксусной кислота проверить по запаху.






