Получение ферментов из культур микроорганизмов является перспективным ввиду неограниченной доступности исходного сырья - бактерий, грибов и актиномицетов. Большие возможности открываются при отборе и искусственном мутагенезе продуцентов для направленного биосинтеза определенных ферментов. Биосинтетические методы отличаются высокой производительностью за счет способности микроорганизмов к интенсивному размножению. Известны бактерли, которые делятся каждые 30-60 мин, в результате чего происходит быстрое накопление целевых продуктов в биомассе или культуральной среде. Поэтому, несмотря на ряд лимитирующих факторов, методы биотехнологии являются экономически более эффективными, чем методы получения биологически активных веществ из дорогого и дефицитного животного сырья.
Биотехнологический процесс включает большую подготовительную работу: очистку и стерилизацию воздуха, посуды и аппаратов; подготовку питательной среды для биосинтеза и ее стерилизацию; выращивание посевного материала исходной культуры. Засев производственной питательной среды и выращивание микроорганизмов (продуцентов ферментов) проводят в ферментаторе. Культивирование микроорганизмов осуществляют в основном глубинным способом в жидкой питательной среде при строго определенном значении рН, времени и температуры, подавая стерильный воздух.
Большинство ферментов промышленного производства относится к внеклеточным, поэтому накапливаются в культуральной жидкости, что значительно упрощает их выделение (схема 19.1). Культуральную жидкость отделяют от частиц мицелия фильтрованием через синтетические ткани, применяемые в пищевой промышленности и обладающие механической и химической прочностью. С целью улучшения процесса фильтрации используют дополнительный фильтрующий слой из материалов, имеющих высокие гидродинамические свойства - перлит, уголь активированный и др. Для повышения качества фильтрата по цветности и прозрачности применяют соосажде-ние мелкодисперсных взвешенных частиц мицелия и высаливание балластных веществ аммония сульфатом. Осветление растворов проводят микрофильтрацией через мембраны с диаметром пор от 0,45 до 0,8 мкм. Снижение микробной контаминации осуществляют стерильной фильтрацией через мембраны с диаметром пор от 0,1 до 0,3 мкм.
СХЕМА 19.1. Технология ферментов, получаемых биотехнологическими методами

При выделении изоферментов (внутриклеточных) основной задачей является сбор клеток, содержащих фермент, с последующей их промывкой буферным раствором. Наилучшие результаты отделения клеток обеспечивает микрофильтрация через мембранные фильтры с диаметром пор 0,45 мкм. Осуществляют ее в тангенциальном потоке, при котором фильтруемая жидкость подается под небольшим углом к поверхности мембраны, что позволяет постоянно смывать слой частиц, образующихся на ее поверхности. Его удаление происходит также за счет высокой скорос ги подачи исходного раствора в фильтрующую систему. Таким путем удается переработать большие объемы растворов и получить высококонцентрированные суспензии.
Следующей стадией выделения внутриклеточных ферментов, (например, аспарагиназы, пенициллиназы) является разрушение клеток путем механической, гидродинамической или ультразвуковой дезинтеграции или лизиса с помощью ферментов и другими способами. Очищают растворы микрофпльтрацией через мембранные фильтры с размером пор 0,22 мкм. Так как целевым компонентом является фильтрат, то наряду с фильтрацией в тангенциальном потоке используют и обычную - через патронные фильтры. Из растворов ферменты выделяют фракционированием нейтральными солями и растворителями, а также изо-электрическим осаждением.
Одним из прогрессивных методов очистки является ультрафильтрация, позволяющая проводить разделение в соответствии с размером молекул или молекулярной массой веществ.ч Основной характеристикой ультрафильтрацпонной мембраны является средний предел полного деления частиц глобулярного белка, которые не проходят через мембрану. Наличие широкого набора мембран с пределами отсечения от I тыс. до 1 млн дальтон (обычно I, 10, 30 тыс. и 1 млн) позволяет отделять различные примеси, очищать, концентрировать и обессоливать целевой продукт. Ультрафильтра цпя осуществляется о тангенциальном потоке, обессоливапне или удаление низкомолекулярных примесей (м.м. ниже предела деления мембраны) - в режиме днафильтрации, т. е. при постоянном объеме фильтруемой жидкости, за счет восполнения фильтрата равным объемом воды или буферного раствора.
Важную роль в технологии выделения и очистки ферментов играют хроматографическис методы. Они включают гель-фильтрацию или эксклюзионную хроматографию, когда время выхода вещества из хро-матографической колонки зависит от размера его молекул или молекулярной массы (более крупные молекулы не входят в поры сорбента и элюнруются раньше); ионообменную хроматографию, разделение при которой основано на различиях в суммарных зарядах присутствующих веществ при данном значении рН
(вещества, имеющие большой заряд, удерживаются сильнее и элюируются позже); обращенно-фазовую или гидрофобную хроматографию, при которой гидрофобные вещества сильнее связываются с поверхностью сорбента и элюируются позже. При очистке ферментов используют один или несколько из указанных методов хроматографического разделения.
Перспективной для выделения и очистки ферментов является аффинная хроматография, разделение с помощью которой основано на том, что один из компонентов смеси обладает повышенной способностью к связыванию с лигандом, присоединенным ковалент-ной связью к инертному носителю. При пропускании смеси белков или культуральной жидкости через колонку, заполненную таким сорбентом, молекулы соединения, обладающие сродством к лиганду, удерживаются в колонке, в то время как другие выходят из нее. Вещество из колонки селективно элюируют с помощью буфера, содержащего лиганд или его аналог, иногда с добавлением какого-либо растворителя.
Препараты ферментов микробиологического синтеза. Террилитин (Terrilytinum) -препарат содержит очищенный протеолитический фермент, получаемый из культуры плесневого гриба Aspergillus terri-cola. Он первый лекарственный микробный фермент, освоенный в 1976 г. отечественной промышленностью по разработкам Всесоюзного научно-исследовательского технологического института антибиотиков и ферментов медицинского назначения (ВНИТИАФ). Подобно большинству белковых препаратов микробного происхождения является комплексным препаратом, представленным тремя протеазами, из которых основное содержание, около 90%, составляет протеаза-1. Молекулярная масса террилитина 26 800, область стабильности при значении рН 4,0-9,0.
Террилитин представляет собой лиофилизирован-ный порошок или пористую массу белого цвета, легко растворим в воде, значение рН I% водного раствора 4,8-6,5; активность, выраженная в протеоли-тических единицах (ПЕ), должна быть не менее 2 в 1 мг. Препарат выпускают в герметически укупоренных флаконах по 200 ПЕ, хранят по списку Б, в сухом, защищенном от света месте, при температуре не выше 4°С. Применяют наружно и в виде ингаляций для расщепления гнойных экссудатов, некротических тканей, при лечении гнойных ран, ожогов, заболеваний верхних дыхательных путей.
Ораза (Orazum)-содержит комплекс амило-литических (амилазы, мальтазы) и протеолитическпх ферментов, получаемых из культуры гриба Aspergillus oryzae. Препарат представляет собой аморфный порошок от светло-желтого до темно-желтого цвета, растворимый в воде, устойчив в интервале значений рН 2,5-9,0. Для медицинских целей его получают из технического продукта амилоризина-ПХ, высушенной и измельченной поверхностной культуры плесневого гриба Aspergillus oryzae, извлеченной водной экстракцией с последующей фракционной очисткой органическими растворителями. Выпускают препарат в форме гранул по 100 г в стеклянных банках. Хранят в сухом, прохладном месте. Применяют при расстройствах пищеварения, протекающих с угнетением функции пищеварительных желез.
Солизим (Solizymum) -ферментный препарат л и политического действия, полученный из культуры гриба Penicillium solitum. Он представляет собой гигроскопический порошок светло-коричневого цвета со слабым специфическим запахом, мало растворимый в воде и практически нерастворимый в этаноле, хлороформе, эфире. Область стабильности при значении рН 6,5-9,5. Активность препарата определяют по способности гидролизовать эмульсию масла оливкового и выражают в ЛЕ (липолитических единицах).
Солизим выпускают в таблетках с содержанием 20 000 ЛЕ. Таблетки получают гранулированием со-лизима и сахара 5% раствором ПВП в хлороформе в установке с псевдоожижением вещества, сушат при температуре не выше 40°С, покрывают оболочкой из ацетилфталилцеллюлозы в спирто-ацетоновом растворе с добавлением красящих веществ. Благодаря оболочке таблетки выделяют фермент лишь в верхних отделах кишечника. Хранят в сухом, защищенном от света месте, при температуре не выше 4°С. Применяют при хронических заболеваниях желудочно-кишечного тракта и панкреатитах.
Стрептолиаза (Streptoliasum) - препарат, содержащий фермент стрептокиназу, получаемый из культуры ^-гемолитического стрептококка группы С. Лиофиллизированный препарат представляет собой пористую массу белого цвета, легко растворимую в воде. Активность стрептолиазы выражают в ЕД. За ЕД принимают количество, лизирующее в определенных условиях сгусток фибрина, образованный смесью растворов фибриногена и тромбина. Выпускают в ампулах по 250 000 и 500 000 ЕД. Хранят при температуре от 4 до 10°С. Применяют в качестве фибрпно-литпческого (тромболитического) средства. Недостатком является малая стабильность в организме: период полураспада стрептокипазы составляет 20-80 мим, ввиду чего препарат вводят внутривенно (в необходимых случаях - внутриартериально) капельно на протяжении 16-18 ч. Высокая иммунная активность является причиной побочных эффектов (озноб, лихорадка, аллергические реакции). Препарат стрептокипазы, лишенный указанных недостатков, получен ее иммобилизацией на водорастворимой полисахаридной матрице (см. стрептодеказу).
А с п а р а г и 11 а з a (Asparaginasum) - L-acna-рагипаза (L-аспарагин-аминогидролаза) - фермент, расш.епляющпй аспарагин на кислоту аспарагииовую и аммиак. Продуцируется разными штаммами кишечной палочки (Escherichia coli). Технология парентерального препарата L-аспарагнназы из Е. coli разработана совместными исследованиями Института органического синтеза (ИОС) АН Латвийской ССР и ВНИИ антибиотиков. Он представляет собой белый аморфный порошок, легко растворимый в воде и изотоническом растворе нагрия хлорида. В качестве стабилизатора содержит глицин. Активность выражается в международных единицах действия (ME). За МЕ принято количество фермента, освобождающее 1 мкмоль аммиака из аспарагина за 1 мин. Препарат выпускают в -лиофилизированном виде во флаконах, содержащих по 3000 и 10 000 ME L-аспарагииазы для инъекций. Хранят по списку Б, при температуре не выше 10°С. Применяют при лечении острой лимфо-бластической лейкемии. Действие основано на том, что некоторые опухоли и лейкемические клетки не синтезируют аспарагин и поэтому нуждаются в его поступлении извне, например с пищей. Введение L-аспарагиназы позволяет искусственно ограничить поступление в опухоли указанной аминокислоты и подавляет их рост.
П е н и ц и л л и н а з a (Penicillinasum) - ФеР~ мент, продуцируемый Bacil lus lecheniformis штамм
749/с. Представляет собой белый аморфный гигроскопический порошок, легко растворимый в воде. Активность препарата выражается в ЕД. За ЕД принимают его наименьшее количество, способное инактивировать 10»' моля (около 60 ЕД) бензил-пенициллина в 1 мл фосфатного буфера в течение 1 ч при температуре 37°С. Препарат выпускают в герметически укупоренных флаконах или ампулах по 500 ООО и 1 ООО ООО ЕД. Хранят при комнатной температуре. Применяют при острых аллергических реакциях и анафилактическом шоке, вызванных препаратами группы пенициллина.
ИММОБИЛИЗОВАННЫЕ ФЕРМЕНТЫ
Иммобилизация ферментов - это повышение их стабильности. В биологических объектах ферменты находятся в фиксированном состоянии на поверхности различных клеточных структур и сохраняют активность в течение длительного времени. В то же время выделенные из органов и тканей или полученные из микробного сырья, особенно в высоко очищенном состоянии, они быстро инактивируются. Поэтому повседневное клиническое использование натнвных ферментов лимитируется прежде всего их высокой лабильностью к различным факторам окружающей среды (значение рН, температура и др.), быстрой инактивацией в организме и выделением из организма, что повышает расход ферментов, а также наличием антигенных свойств чужеродных организму белков. Перечисленные недостатки в значительной степени могут быть устранены при использовании ферментов в иммобилизованном виде.
При создании иммобилизованных ферментов, применяемых в медицине, определили два направления:
1) когда присутствие фермента необходимо в разных органах или он предназначен для длительной циркуляции в кровотоке, получают его стабилизированные водорастворимые формы. К этой группе могут быть отнесены и искусственные клетки, наполненные ферментами: микрокапсулы, липосомы и клетки крови;
2) при лечении очаговых заболеваний целесообразны иммобилизованные ферменты, которые могут быть локализованы в определенном месте организма и способны к его выделению с заданной скоростью в окружающую среду. Однако необходимость введения иммобилизованного фермента в организм отпадает, если он действует на субстрат, присутствующий в биологических жидкостях. В этих случаях используют системы экстракорпоральной перфузии, помещая иммобилизованный фермент в закрытую систему, через которую циркулирует биологическая жидкость (кровь, лимфа и др.), возвращающаяся в организм освобожденной от вредного метаболита.
Водорастворимые препараты иммобилизованных ферментов. Высокомолекулярные водорастворимые производные ферментов на данном этапе развития медицинской энзимологии являются их наиболее рациональными формами. Фермент и полимер, как правило, соединены ковалентной связью. Молекула фермента обволакивается макромолекулой полимера в результате образования между ними 6-10 ковалент-ных связей. Многоточечное взаимодействие фермента с носителем делает его конформацию более жесткой и менее подвижной. Фермент оказывается заключенным в полимерную оболочку, имеющую вид петель и достаточно хорошо проницаемую для высокомолекулярных субстратов. Поэтому такие соединения получили название «открытые» макромолекулярные капсулы. Водорастворимые полимерные производные ферментов характеризуются повышенной стабильностью in vitro и in vivo, увеличенным временем циркуляции в кровотоке, что обусловливает пролонгирование их действия в организме. Они оказывают менее выраженное побочное действие, что связано с пониженной по сравнению с нативными ферментами способностью стимулировать образование антител и реагировать с ними вследствие затруднений для специфического взаимодействия антиген - антитело.
Положительные качества ферментов, модифицированных водорастворимыми полимерами, открывают широкие перспективы для их клинического использования. Определенные успехи в этом направлении достигнуты при применении в клинике иммобилизованных протеаз в качестве фибринолитических и противовоспалительных препаратов. Особое значение в этой связи приобретают разработка и внедрение в клинику стрептодеказы.
Стрептодеказа для инъекций (Strep-toclecasum pro injectionibus) - первый препарат пролонгированного действия для тромболитической терапии, полученный на основе иммобилизованного фибри-нолизина (стрептокиназы) и разрешенный к медицинскому применению в 1981 г. Над созданием препарата работали коллективы ВНИИ ТИАФ, Всесоюзного кардиологического научного центра (ВКНЦ) АМН СССР и ИОС АН Латвии.
В качестве водорастворимого полимера-носителя для иммобилизации стрептокиназы использован дек-стран с м.м. 60 000, выпускаемый под названием полиглюкин. Предварительное активирование иоли-глюкина проводят калия периодатом при комнатной температуре и перемешивании раствора в течение 1 ч. Очистку окисленного полиглюкина от примесей осуществляют хроматографической адсорбцией.
Для иммобилизации стрептокиназы к ее раствору приливают раствор окисленного полиглюкина, имеющего значение рН 8,7, и перемешивают в течение 1 ч. Аминогруппы стрептокиназы и альдегидные группы окисленного полиглюкина взаимодействуют с образованием азометиловой связи. Затем реакционную смесь охлаждают до 4°С. Последующее восстановление стрептодеказы проводят при добавлении к реакционной массе натрия боргидрида и перемешивании в течение 1 ч при температуре 4°С. Азометиловые связи (-CH-N-) между полимером и белком восстанавливаются до Н2С-NH-связей, а избыток аль
I I
дегидных групп полимера (реакционные группы, оставшиеся после реакции) - до гидроксильных. После определения фибринолитической активности раствор концентрируют с помощью ультрафильтрации. Концентрат подвергают стерилизующей фильтрации и затем.сублимационной сушке.
Препарат представляет собой порошок или пористую массу белого цвета. Выпускают в герметически укупоренных флаконах вместимостью 10 мл, содержащих по 1 500 000 или 1 000 000 ФЕ (фибринодитиче-ских единиц) стрептодеказы (в пачках по 2 флакона). Хранят по списку Б, при температуре не выше 10°С. Стрептодеказу обычно в дозе 2 700 000 ФЕ (через 1 ч после пробной инъекции 300 000 ФЕ) вводят однократно, внутривенно, струйно, растворяя непосредственно перед применением в 20-50 мл изотонического раствора натрия хлорида. В этой дозе препарат вызывает значительное повышение фибриполнти-ческой активности крови и действует в течение 48-72 ч.
Включение ферментов в микрокапсулы. Микро-капсулирование ферментов состоит во включении их водных растворов в полупроницаемые мембраны толщиной около 20 им, непроницаемые для ВМС и клеток, но через которые могут проникать низко-молекулярные вещества. Наличие ультратонкой мембраны позволяет создать высокие концентрации фермента в малых объемах раствора, находящегося в микрокапсуле, и сохранять стабильность и биологическую активность инкапсулированных ферментов. Использование фермента в высоких концентрациях, а также большие значения отношения площади поверхности микрокапсул к их объему обеспечивают быструю диффузию низкомолекулярного субстрата из внешней среды к ферменту и продукта реакции из внутреннего объема микрокапсулы в межкапсулярное пространство.
Получены и исследованы микрокапсулнрованные формы ряда ферментов, катализирующих различные превращения ннзкомолекулярных субстратов. Так, микрокапсулированная каталаза, введенная внутривенно или внутрмбрюшпнно мышам с наследственным нарушением синтеза этого фермента, эффективно снижала содержание перборатов в крови и имела более длительный период жизни в организме, чем свободный фермент. Микрокапсулированная аспара-гиназа, введенная мышам с аспарагинзависимыми опухолями, вызывала стойкое и длительное снижение аспарагина в крови, что препятствовало росту злокачественных новообразований. Микрокапсулированная уреаза после введения крысам в желудочно-кишечный тракт вызывала существенное понижение содержания мочевины в крови. Следует отметить, что все исследования микрокапсул и рованных ферментов проводятся только на животных. Это связано с тем, что при иитракорпоральном их введении материал, используемый для создания мембран, накапливается в основном в селезенке и печени и может быть далеко не безразличен для организма.
Идеальным материалом с точки зрения биологической утилизации микрокапсул в организме человека и животных могут быть различные природные мембраны клеток крови. Фермент при относительно мягких условиях (нейтральная среда, небольшая ионная сила и т.д.) может быть заключен в частично гемоли-зованные клетки крови (эритроциты, тромбоциты) с последующим восстановлением целостности их мембран. Поскольку размер ферментных элементов крови мал, а время жизни их в кровяном русле относительно велико, такие микрокапсулы могут беспрепятственно и длительно циркулировать в крови. В форменные элементы крови включены такие ферменты, как |3-глю-козидаза, Р-галактозидаза, а-амилаза, пероксидаза, аргиназа, аспарагиназа и некоторые другие. Все иммобилизованные в клетки крови ферменты имеют неизменяемые каталитические параметры п отличаются большей устойчивостью к повышению температуры.
Применение микрокапсул, содержащих ферменты, экстракорпорально через шунты или камеры имеет хорошую перспективу. Одно из преимуществ состоит в том, что не происходит контакта фермента с им м у некомпетентным и клетками, тем самым исключается возмодность сенсибилизации организма со всеми неблагоприятными последствиями. Кроме того, применение вне организма исключает накопление в нем искусственных клеток и снимает проблему разрушения и утилизации полимерных материалов. Благодаря ультратонкой полупроницаемой мембране и высоким значениям отношения площади поверхности микрокапсул к их объему, скорость диффузии низкомолекулярных веществ через микрокапсулы выше, чем через диализную мембрану в аппарате искусственная почка. Принцип энзиматического превращения вредных метаболитов с помощью микрокапсулирован-ных ферментов разрабатывается для применения в аппаратах искусственная почка и искусственная печень. Перспективным может оказаться использование микрокапсулированных ферментов для удаления мочевины - одного из самых токсичных метаболитов клетки. Одним из способов является превращение мочевины под действием микрокапсулированной уреа-зы в аммоний и углерода диоксид. Вторым - использование экстракорпорального шунта, снабженного микрокапсулами с мультиферментными рециклиру-ющими комплексами. С помощью таких микрокапсул, благодаря сложной цепи рециклирующих реакций, мочевина и аммоний превращаются в аминокислоты: глутамат, оксиглутарат, аланин.
Включение ферментов в липосомы. Лнпосомы - биелойные сферические образования с водной фазой внутри и размером несколько сотен ангстрем или полибислойные образования, состоящие из нескольких концентрических бислоев с внутренней полостью и размером до многих сотен ангстрем и даже до 1 мкм. Для получения липосом ферменты или другие биологически активные вещества в водных растворах подвергают ультразвуковой обработке в присутствии положительно или отрицательно заряженных фосфо-липидов.
Липосомы после разрушения составляющих их фосфолипидов могут быть утилизированы как компоненты клеточных мембран. Кроме того, они дают уникальную возможность введения фермента внутрь клеток, с которыми взаимодействуют. В зависимости от физических параметров фосфолипидов (заряд, жидкость, размер) липосомы проникают в клетку посредством эндоцитоза или за счет слияния с природными мембранами. При эндоцитозе липидная оболочка липосом внутри клеток разрушается фосфо-липазами лизосом и лекарственное вещество освобождается в цитоплазму; при слиянии с клеточной мембраной липидиый компонент липосом входит в состав клеточных мембран, а его лекарственное содержимое поступает в цитоплазму.
Распределение липосом по различным органам при их введении животным детально изучено. Основная их часть (от 50 до 80%) поглощается клетками ре-тикулоэндотелиальной системы, в первую очередь находящимися в печени и селезенке. Свойство липосом избирательно-концентрироваться в клетках ретикуло-эндотелиадьной системы использовано для лечения генетически обусловленных нарушений синтеза и функционирования лизосомальных гидролаз печени. При этом следует отметить, что пораженная печень накапливает в несколько раз больше липосом, чем здоровая. При лечении ферментом, включенным в липосомы, больного с дефицитом лизосомальной а-глкжо-зидазы, сопровождающимся усиленным накоплением гликогена в печени, наблюдали быстрое (в течение недели) снижение уровня гликогена и уменьшение размера печени. Положительный терапевтический эффект на людях отмечен при использовании включенной в липосомы глюкоцереброзидазы при болезни Гоше, связанной с нарушением метаболизма глюко-цереброзидов, накапливающихся в клетках ретикуло-эндотелиальной системы в результате дефицита соответствующего лизосомального фермента.
Направленность действия лилосом (органотроп-ность) может быть изменена при изменении состава компонентов, образующих мембрану, а сродство ли-посом к клеткам-мишеням усилено с помощью специфических факторов (антитела, лектины и др.).
Препараты иммобилизованных ферментов, применяемые при локальных заболеваниях. При локальных заболеваниях целесообразно использование иммобилизованных ферментов, которые могут быть локализованы в определенном месте организма и способны к постепенному выделению в окружающую среду. При получении таблеток и гранул ферментных препаратов (трипсина, лизоцима, щелочной фосфатазы, ка-талазы и др.) предложено вводить их в смеси с биосовместимыми полимерами (полиакриламидом, поли-впнилпирролидоном, спиртом поливиниловым и др.). Имплантированный в очаге поражения или поблизости от него находящийся в полимере фермент практически полностью защищен от воздействия агрессивной физиологической среды. Вместе с тем из полимера фермент выходит в нативном состоянии и скорость его последующей инактивации и выведения, как и вызываемые им токсические, аллергические и иммунные реакции, та же, что и для нативного фермента, применяемого традиционным способом.
Перспективны рассасывающиеся в организме фер-ментосодержащие препараты, которые с помощью катетеризации могут вводиться непосредственно в мышечную ткань или капиллярную сеть пораженного органа и поддерживать там высокую локальную концентрацию стабилизированного фермента.
В качестве полимерного носителя использовали сефадекс, который предварительно окисляли кислотой йодной или натрия перйодатом. Полученные при окислении альдегидосефадексы способны к медленному растворению. Изменение степени окисления позволяет варьировать их растворимость в самых широких пределах. Иммобилизованный на таком носителе фермент переходит в раствор ковалентно связанным с осколком (фрагментом) носителя, который не только дополнительно его стабилизирует, но и уменьшает вызываемые ферментом нежелательные реакции организма.
Иммобилизованные на частично окисленных полисахаридах тромболитические фермент ы показали большую перспективность для терапии тромбозов. Лизис тромба достигается меньшей дозой иммобилизованного фермента, депонируемого непосредственно в месте расположения тромба методом катетеризации.
К биодеградируемым препаратам могут быть отнесены ферменты, иммобилизованные в структуре полимерных волокон и пленок в процессе их формирования. Различают обычные и полые волокна. Для получения обычных волокон к раствору полимера (триацетатцеллюлоза, нитроцеллюлоза, этил целлюлоза, поливинилхлорид и др.) в органическом растворителе добавляют водный раствор или суспензию фермента. Смесь эмульгируют и продавливают через мелкое сито в коагулируемую жидкость. Образующиеся волокна представляют собой полимерные гели, которые содержат в структуре водный раствор фермента. Полые волокна изготавливают из природных или синтетических полимеров, таких как целлюлоза, поливинилхлорид, полисульфон, полиакрил амид, нейлон. Полые волокна состоят из основной массы полимерной матрицы, которая имеет внутреннюю полую область, заполненную раствором фермента. Он удерживается в полой области волокна за счет физической иммобилизации или химической связи между аминогруппами фермента н активными группами, находящимися на внутренней поверхности волокна. Каталитические свойства ферментов, включенных в волокна, используются в медицине в экстракорпоральных шунтах для детоксикации организма при различных патологических состояниях и в терапии субстрат-зависимых опухолей, а также в ферментативных реакторах при диагностических определениях концентрации метаболитов в крови. Так, уреаза, включенная в волокна из триацетатцеллюлозы, химически сшитая с помощью глутарового альдегида с нейлоновыми трубками, эффективно снижала уровень мочевины в крови животных. Уреаза, иммобилизованная на нейлоновых трубках, оказала положительный терапевтический эффект при лечении больных, страдающих гиперуриксмией, обеспечив быстрое удаление уратов из кровяного русла. Подсоединение экстракорпоральных шунтов, содержащих аспарагиназу, включенную в волокла из трнацетатцеллюлозы и дакрона или ко-валентно пришитую за счет глутарового альдегида к внутренней поверхности нейлоновых трубок, приводило к полному удалению аспарагина из кровяного русла животных.
Протеолитические ферменты, включенные в систему нерастворимых (фторопласт-42 и др.) и растворимых (ПВС и др.) в воде полимеров, используются при гнойных ранах. Фермент выделяется благодаря диффузии или постепенному растворению пленки. Применение полимерных пленок ускоряет очищение ран в 3-4 раза, расход фермента на курс лечения снижается приблизительно в 20 раз.
Контрольные вопросы
1. Перечислите ферментные препараты, получаемые из микроорганизмов.
2. Объясните особенности выделения внеклеточных и внутриклеточных ферментов из микроорганизмов.
3. Укажите способы иммобилизации, наиболее рациональные для ферментов.
4. Назовите особе!!ности биодеградируемых ферментных препаратов.
5. Как получают стрептодеказу? В какой лекарственной форме ее выпускают? Как применяют?
Глава 20
СУСПЕНЗИИ И ЭМУЛЬСИИ (SUSPENSIONES ЕТ EMULSA)
Определение лекарственных форм - суспензии и эмульсии как систем гетерогенных, механизм стабилизирующего действия ВМС и ПАВ, их классификацию и характеристику см. том 1.
В данной главе найдут отражение особенности промышленного производства суспензий и эмульсий.
Производство суспензий и эмульсий. Получение суспензий и эмульсий на крупных фармацевтических предприятиях осуществляется разными способами: интенсивным механическим перемешиванием с помощью быстроходных мешалок и РПА; размолом твердой фазы в жидкой среде на коллоидных мельницах, ультразвуковым диспергированием с использованием магнитострикционных и электрострикцион-ных излучателей. Микрокристаллические взвеси получают также конденсационным способом, направленной кристаллизацией при смешивании растворов в определенных условиях температурного режима, характера перемешивания, значения рН среды и т. д.
Твердое вещество предварительно измельчают до мелкодисперсного состояния на специальных машинах, готовят концентрированную суспензию перемешиванием в смесителях, затем многократно диспергируют на коллоидных мельницах или на ультразвуковых и других установках. Для «сухих» суспензий, представляющих собой смесь лекарственного и вспомогательных веществ, образующих взвесь после добавления воды (в аптеке или домашних условиях), каждый ингредиент измельчают отдельно и просеивают через тонкое сито. После смешивания ингредиентов во избежание расслоения смесь вновь просеивают. Полученную готовую продукцию подвергают анализу в соответствии с требованиями НТД, стандартизуют и фасуют.
Для механического диспергирования применяют пропеллерные и турбинные мешалки закрытого и открытого типов. Пропеллерные мешалки создают круговое и осевое движение жидкости со скоростью 160- 1800 об/мин и применяются для маловязких систем. В процессе перемешивания часто используют вакуум для удаления пузырьков воздуха, которые понижают устойчивость системы. Более мелко диспергированные и стойкие суспензии и эмульсии можно получить с помощью турбинной мешалки, создающей турбулентное движение жидкости. Мешалки открытого типа представляют собой турбинки (рис. 20.1, а, б) с прямыми, наклонными под разными углами или криволинейными лопастями.
Мешалки закрытого типа - это турбинки, установленные внутри неподвижного кольца с лопастями, изогнутыми под углом 45-90° (рис. 20.1, в). Жидкость входит в мешалку в основании турбинки, где расположены круглые отверстия, и под действием центробежной силы выбрасывается из нее через прорези между лопастями кольца, интенсивно перемешиваясь во всем объеме реактора. Скорость вращения турбинки 1000-7000 об/мин.

Рис. 20.1. Устройство турбинных мешалок, а, б - открытого; в - закрытого типа.

Рис. 20.2. Устройство РПА проточного типа.
1 - приводной вал; 2 -- рогор; 3 - патрубок выхода суспензии, 4 - крышка-статор; 5 - патрубок л хода.
В промышленной технологии суспензионных и эмульсионных препаратов широкое распространение нашли РПА. При получении дисперсных систем РПА могут быть непосредственно погруженными в реактор с перемешиваемой средой, иногда в дополнение к имеющейся в нем мешалке. РПА погружного типа имеют ротор и статор с концентрически расположенными на них зубцами или цилиндрами с отверстиями и по форме напоминают мешалки. РПА проточного типа устанавливается вис реактора (рис. 20.2). Ротор и статор его заключены в корпус, имеющий входной и выходной патрубки. Обрабатываемая смесь поступает по осевому патрубку внутрь аппарата и под действием центробежной силы выбрасывается через выходной патрубок. Движение жидкости в аппарате осуществляется от центра к периферии. Существуют РПА, в которых движение обрабатываемой среды имеет противоположное направление, от периферии к центру, и диспергированная жидкость выходит через осевой патрубок.
В процессе работы РПА развиваются интенсивные механические воздействия на частицы дисперсной фазы, вызывающие турбулизацию и пульсацию смеси. Для повышения эффективности диспергирования разработаны конструкции РПА с раздельной подачей компонентов обрабатываемой среды по специальным каналам в теле статора, с дополнительными рабочими элементами в виде лопастей на роторе или статоре, с диспергирующими телами (шары, бисер, кольца), свободно размещенными в полостях ротора, с роликовыми подшипниками в обоймах. Диспергирование в РПА такого типа происходит за счет соударения свободно размещенных тел с вращающимися и неподвижными элементами, а также путем раздавливания и истирания материала в местах контакта роликов с вращающимися и неподвижными обоймами. Распространены РПА с рифлеными поверхностями рабочих частей с различного рода зазорами между ними. Чем меньше зазор между вращающимися и неподвижными цилиндрами, тем выше степень дисперсности. Наиболее приемлем для получения мелко измельченных дисперсий радиальный зазор в 0,15- 0,3 мм.

Рис. 20.3. Устройство фрикционной коллоидной мельницы.
1 - осгювлние с коническим гиодо.и; 2 - отверстие в гнездо; 3 - jtornp;
4- микрометрический спит.
Значительно повышается эффективность диспергирования в РПА с увеличением концентрации суспензии, так как измельчение происходит не только за счет РПА, но и путем интенсивного механического трения частиц дисперсной фазы друг с другом. Полученная концентрированная суспензия смешивается затем с остальной частью дисперсионной среды до получения требуемого готового продукта.

Рис. 20.4. Устройство коллоидной мельницы ударною тши.
1 - nwpnjc; 2 - ДИСК. 3--1 - 1Ы.1ЫШ.
С помощью РПА можно совмещать операции диспергирования порошкообразных веществ и эмульгирования смесей. Таким образом, использование РПА обеспечивает получение многофазных гетерогенных систем - эмульсионно-суспензионных смесей, таких как линимент стрептоцида, синтомицина и т. д.
Применение РПА в химико-фармацевтической промышленности дает возможность получения высококачественной продукции, повышения производительности труда, сокращения непроизводительных расходов и т. д.
Для получения суспензий и эмульсий применяют коллоидные мельницы, работающие по принципу истирания твердых частиц, фрикционные (рис. 20.3), удара (рис. 20.4) или истирания и удара (рис. 20.5), кавитации (рис. 20.6).
Измельчение осуществляется в основном в жидкой среде. Рабочие поверхности мельниц гладкие или рифленые, по форме в виде усеченного конуса - ротора, вращающегося в коническом гнезде - статоре, или в виде плоских дисков, из которых один неподвижен; или оба диска вращаются в разные стороны. На дисках укреплены пальцы или имеются канавки.
При работе фрикционной мельницы ротор вращается со скоростью до 20 000 об/мин, диспергируемая смесь засасывается в щель между ротором и статором, размер которой регулируется микровинтом и составляет 0,025-0,05 мм. Смесь многократно прогоняется через щель до получения суспензии с очень небольшим размером частиц.

Рис. 20.5. Устройство роторно-бильной коллоидной мельницы.
1 - корпус, 2 - штуцер для ввода суспенани; 3 - ротор; 4 - билльг, 5 - кошрударники;
6 - штуцер для вывода готовой продукции.

Рис. 20.6. Устройство виброкавитационной коллоидной мельницы.
1 - корпус; 2 - статор; 3 - ротор; 4 - канавки ото поверхности ротора и статора; 5 - штуцер для ввода суспензии;
6 - штуцер для вызола готовой продукции.
В коллоидную мельницу, работающую по принципу удара, смесь подается между вращающимся диском и корпусом с насаженными на них пальцами. При вращении диска частицы дисперсной фазы подвергаются мощному гидравлическому воздействию, возникающему в результате бесчисленных ударов пальцев по жидкости, образуя тонкую суспензию или эмульсию.
Весьма эффективными в производстве эмульсий и суспензий являются устройства для ультразвукового диспергирования. При озвучивании гетерогенных жидкостей в зонах сжатия и разрежения возникает давление. Избыточное давление, создаваемое ультразвуковой волной, накладывается на постоянное гидростатическое давление и суммарно может составлять несколько атмосфер. В фазу разрежения во всем объеме жидкости, особенно у границ раздела фаз, в местах, где имеются пузырьки газа и мельчайшие твердые частицы, образуются полости, кавитационные пузырьки. При повторном сжатии кавитационные пузырьки захлопываются, развивая давление до сотен атмосфер. Образуется ударная волна высокой интенсивности, которая приводит к механическому разрушению твердых частиц и вырывает с поверхности раздела фаз небольшие объемы жидкости, распадающиеся на мелкие капельки и снова входящие в нее. В процессе озвучивания системы происходит не только диспергирование частиц, но и коагуляция, если превзойден предел интенсивности ультразвука и вследствие этого нарушена целостность защитных слоев частиц дисперсной фазы. С введением стабилизирующих веществ эффективность эмульгирующего действия ультразвука резко возрастает, повышается и степень дисперсности.
Существует определенная зависимость между интенсивностью ультразвука и типом получаемой эмульсин. При низкой интенсивности ультразвука образуется эмульсия типа масло в воде, с увеличением се - вода в масле.
Для получения ультразвуковых волн используют различные аппараты и установки, генерирующие ультразвуковые колебания. Источниками ультразвука могут быть механические и электромеханические излучатели, последние подразделяют на электродинамические, магнитострикционные и электрострикциониые.
К преобразователям механической энергии в ультразвуковую относится жидкостной свисток.
Принцип его работы заключается в подаче под давлением струи жидкости через сопло на острие закрепленной в двух точках пластинки (рис. 20.7). Под ударом струи жидкости пластинка колеблется и излучает два пучка ультразвука, направленных перпендикулярно к ее поверхности. При получении эмульсин жидкостной свисток помещают в сосуд с дисперсионной средой и через него под давлением в несколько атмосфер подают дисперсную фазу. Частота колебаний, возбуждаемых излучателем, составляет около 30 кГц.
К электродинамическим излучателям относится высокочастотный ротационный аппарат, построенный по типу турбинной мешалки. Возбудимый им ультразвук имеет низкую интенсивность.

Рис. 20.7. Жидкостной свисток (схема).
1 - сопло, 2 - ичб(ыцио1шая пластично; 3 - пучки ультроэауха.
Магнитострикционные излучатели (рис. 20.8) представляют собой вибрационные устройства, состоящие из магиитопровода (металлического стержня) с обмоткой, вмонтированного в сосуд с диспергируемой средой. Магнитопровод изготавливают из ферромагнитных металлов, различных сплавов и других материалов, способных менять линейные размеры при намагничивании. Такими свойствами обладают никель, железо, кобальт, нержавеющая сталь, сплавы в системах железо - никель, железо - кобальт и др. Для уменьшения потерь на вихревые токи магнитопровод изготавливают из тонких изолированных друг от друга пластин толщиной 0,1-0,3 мм, покрытых никелем. Во избежание повышения температуры при работе магнитостриктора внутри металлического стержня оставляют узкий канал, через который для его охлаждения циркулирует холодная вода. При пропускании по обмотке переменного тока соответствующей частоты возникает магнитное поле и происходит деформация магнитопровода по его продольной оси. Образуются ультразвуковые колебания, размах которых увеличивается, когда излучатель работает в условиях резонанса возбуждаемых частот и собственных колебаний стержня.

Рис.20.8. Устройство магннтострнкцнонного излучателя.
1 - сосуд;2 - никелевый стержень; 3 - муфта; 4 - обмотка для пропускания переменного тока.
Электрострикционные (пьезоэлектрические) излучатели представляют собой устройства, действие которых основано на пьезоэлектрическом эффекте, используются при получении ультразвука высокой частоты, от 100 до 500 кГц. Пьезоэлементами служат пластинки, изготовленные из кварца или других кристаллов, колеблющихся по толщине. Эти пластинки имеют прямоугольную форму, размер их не менее 10 X 15 X 1 мм3. Одна из граней пластинки должна быть параллельна оптической оси кристалла, другая - одной из его электрических осей. Для создания резонанса частот пластинка с обеих сторон снабжается металлическими обкладками. При сжатии или растяжении таких пластинок вдоль электрической оси, на их поверхности возникают противоположные электрические заряды. Это явление называется пьезоэффек-том. При наложении электрического поля пластинка испытывает деформацию растяжения (при отрицательном заряде) или сжатия (при положительном заряде), т. е. в переменном электрическом поле прьезоквар-цевая пластинка совершает резонансные колебания (обратный пьезоэлектрический эффект). Для повышения интенсивности излучателя изменяют форму пластинки и применяют вогнутые, сферические и цилиндрические излучатели.
Схема диспергирования с помощью электрострик-ционного излучателя представлена на рис. 20.9. Пьезоэлектрический элемент (1) устанавливается в масляной бане на специальном механизме (2) (масло играет роль изолирующего агента и является хорошим проводником акустической энергии). Над ним на расстоянии около 5 мм закрепляется колба с диспергируемыми веществами. К пьезоэлементу (металлическим обкладкам пластинки) подводится источник переменного тока высокой частоты через газотронный выпрямитель н генератор, чтобы направление тока совпало с электрической осью элемента. Чередующиеся сжатия и разрежения в масле от пьезоэлемента передаются через стекло колбы в диспергируемую систему. Для предохранения от перегрева содержимого колбы вокруг нее размещают змеевик для пропускания холодной воды.
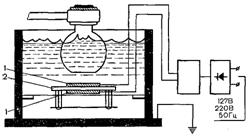
Рис. 20.9. Устройство электрострикционного излучателя.
Объяснение в тексте.
Применение ультразвука дает возможность получить монодисперсные системы с размером частиц дисперсной фазы в интервале 0,1-1,0 мкм и менее 0,1 мкм. Однородность и высокая степень дисперсности обеспечивает их более высокую биологическую доступность. Суспензии и эмульсии, полученные с помощью ультразвука, отличаются большей устойчивостью при хранении, чем полученные путем механического диспергирования. Озвученные эмульсии называются реверзибильными - возвращенными. В случае расслаивания они легко ресуспендируются при встряхивании.
Благодаря бактерицидному действию усльтразвука, полученные эмульсии и суспензии стерильны.
Стандартизация. Оценка качества готовой продукции проводится по содержанию действующих веществ. Регламентируется показатель значения рН среды, степень дисперсности частиц твердой фазы суспензий и капель эмульсий, скорость оседания частиц дисперсной фазы суспензий. Контролируется термостабильность и морозостойкость эмульсий: при выдерживании пробы эмульсии (30,0 г) в термостате при 45°С в течение 8 ч отделяющийся масляный слой не должен превышать 25% общей высоты эмульсии. При охлажденпи до - 20°С в течение 10 ч после оттаивания при комнатной температуре не должно быть расслаивания.
Хранение. Суспензии и эмульсии хранят в стеклянных флаконах или банках темного стекла, плотно закрытых винтовой крышкой, в прохладном, защищенном от света месте, с указанием на этикетке срока годности препарата.
Номенклатура суспензий и эмульсий многочисленна и разнообразна. Для примера представлены некоторые прописи суспензий, линиментов-эмульсий и линиментов-суспензий промышленного производства.
Линимент нафталанской нефти 10% (Linimentum Naphthalan! liquidi 10%). Состав: нефти нафталанской 10,0 г, эмульгатора № 1 6,0 г, воды дистиллированной до 100,0 г.
Линимент стрептоцида 5% (Linimentum Streptocidi albi 5%). Состав: стрептоцида белого 5,0 г, рыбьего жира трескового или жира других рыб и морских млекопитающих 34,0 г, бутилоксианизола 0,02 г, эмульгатора № 1 5,0-6,0 г, натрия карбокси-метилцеллюлозы 1,68 г, воды дистиллированной до 100,0 г.
Линимент синтомицина 1% с новокаином 0,5% (Linimentum Synthomycini 1% cum Novocaino 0,5%). Состав: синтомицина 1,0 г, новокаина 0,5 г, масла касторового 20,0 г, эмульгатора Лг? 1 4,0-6,0 г, эмульгатора Т-2 4,0 г, кислоты сор-биновой 0,2 г, этанола 95% 1,4 г, воды дистиллированной до 100,0 г.
Линимент алоэ (Linimentum Aloes). Состав: сока алоэ древовидного (консервированного) из био-стимулированных листьев 78,0 г, масла касторового 10,0 г, эмульгатора № 1 10,0 г, масла эвкалипта 0,1 г, кислоты сорбиновой 0,2 г, натрия карбоксиметилцсл-люлозы 1,5 г.
Суспензия гризеофульвина (Suspensio Griseoiulvini). Состав: гризеофульвина 1,0 г, сахара 50,0 г, натрия бензоата 0,5 г, спирта поливинилового 1,2 г, натрия хлорида 0,4 г, раствора сахарина 0,4 мл, масла мяты перечной 0,015 г, воды дистиллированной до 100,0 г.
Вий охи нол (Biiochinolum). Состав: 8% взвесь хинина йодовисмутата в нейтрализованном масле персиковом.
Суспензии инсулина см. главу 18.
Контрольные вопросы
1. Какими методами получают суспензии и эмульсин на фармацевтических производствах?
2. Какие факторы обусловливают устойчивость суспензий н эмульсий?
3. Какую роль играют вспомогательные вещества в производстве суспензий и эмульсий?
4. Из каких стадий складывается процесс получения дисперсионных препаратов?
5. Какие препараты используются в производстве суспензий и эмульсии?
6. Каков принцип работы турбинных мешалок и РПА?
Глава 21
МАЗИ (UNGUENTA)
Определение мазей как лекарственной формы, требования, предъявляемые к ним, классификацию и характеристику мазевых основ см. том 1.
ТЕХНОЛОГИЯ МАЗЕЙ
Производство мазей на крупных фармацевтических предприятиях осуществляется в соответствии с регламентом, разработанным на основе научных исследований, и сосредоточено в специальных цехах, оснащенных необходимым оборудованием. Технологический процесс находится под строгим контролем ОТК на каждой стадии производства, так как любое отклонение от регламента может привести к снижению качества выпускаемой продукции и в конечном итоге к большим материальным потерям.
Технология мазей состоит из следующих основных стадий: подготовка основы для мазей и лекарственных веществ, введение лекарственных веществ в основу, гомогенизация мазей, стандартизация, фасовка и хранение мазей.
Подготовка основы для мазей и лекарственных веществ. Основу для мазей расплавляют с помощью паровой иглы или змеевика в таре (бочке, баках) и перемещают в варочный котел. Существуют также специальные устройства для расплавления и транс портировки основы с помощью вакуума (рис. 21.1). Это воронка с фильтром и кожухом, снабженная нагревательными элементами, получающая питание от сети переменного тока. Воронка помещается в емкость с основой и нагреваясь, плавит ее. Если в основу входят несколько компонентов, плавление начинают с тугоплавких веществ. При необходимости для удаления механических включений основу фильтруют через холст или марлю. Далее основу по обогреваемому трубопроводу переводят в варочный котел или смеситель. При получении эмульсионных основ ПАВ вводят в ту же фазу, в которой они больше растворимы. Эмульгирование проводят в реакторах с мешалками или барботированием фильтрованного воздуха.
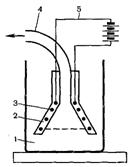
Рис. 21.1. Устройство для плавления мазевых основ (схема).
1 - емкость с мазевой основой; 2 -- воронки с фильтром и кожухом; 3 - нагревательные элементы;
4 - шланг для передачи мзэй В емкость. 5 - iuth'i ник переменного тока.
Лекарственное вещество измельчают, просеивают через сито с определенным диаметром отверстий, растворяют в воде или подходящем компоненте мазевой основы.
Введение лекарственных веществ в основу. Добавление твердых лекарственных веществ или их растворов к основе осуществляется при постоянном перемешивании в 2-вальцовых смесителях, в реакторах с паровой рубашкой или электрическим обогревом, снабженных мощными лопастными мешалками: якорной, планетарной или рамной, которые позволяют перемешивать мази во всем объеме при различных температурах. На современных фармацевтических предприятиях используются реакторы более совершенных конструкции отечественного производства и иностранных фирм. На рис. 21.2 представлено устройство реактора для смешивания густых продуктов. Реактор с полусферическим дном, закрывающийся выпуклой крышкой с загрузочной воронкой, снабжен тремя мешалками, обеспечивающими хорошее перемешивание и перетирание компонентов мази. Реактор имеет пультовое управление.,,
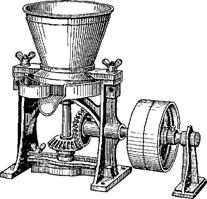
Гомогенизация мази. Стадия гомогенизации является специфической для производства мазей в больших количествах, так как при перемешивании не всегда удается получить необходимую степень дисперсности лекарственных веществ. Для гомогенизации в производстве используют жерновые мельницы, валковые мазетерки.
Жерновая мельница имеет два жернова (рис. 21.3), верхний отлит вместе с загрузочной воронкой, неподвижен, нижний вращается в горизонтальном направлении. На поверхности жерновов имеются бороздки, более глубокие в центре, у краев исчезающие. Мазь гомогенизируется в просвете между жерновами и выдавливается к краям, где с помощью скребка собирается в приемник. Степень дисперсности частиц в мази определяется расстоянием между жерновами. Производительность мельницы 60-80 кг/ч.
Валковые мазетерки имеют два или три валка с гладкой поверхностью, вращающиеся навстречу друг другу с разной скоростью (рис. 21.4), что обеспечивает переход мази с вала на вал и увеличивает трение между ними.
В настоящее время для гомогенизации мазей, особенно эмульсионных, суспензионных и комбинированных, применяется РПА (рис. 21.5), успешно используемый на целом ряде промышленных предприятий: Ленинградской и Московской фармацевтических фабриках, Борисовском химико-фармацевтическом заводе для производства ихтиоловой, скипидарной, цинковой, борной и других мазей. При приготовлении мазей из серы, цинка оксида и других аморфных веществ с использованием РПА, стадии предварительного измельчения лекарственных веществ можно опустить, что дает значительный экономический эффект.
Перспективным для лечения гнойных ран, хирургических инфекций, аугодермопластпки является производство, мазевых повязок, широко выпускаемых зарубежными фирмами. Мази, приготовленные на вазелине, наносят на хлопчатобумажную или вискозную ткань и накладывают на раневые поверхности. Мазевая повязка обеспечивает отток экссудата, гигиенична, способствует.быстрому заживлению ран.

| 
|
| Рис. 21.2. Устройство реактора-смесителя. 1 - корпус; 2 - крышка; 3, 4, 5 - мешалки (якорная, лопастная, турбинная); 6 - паровая рубашка корпуса. | Рис. 21.3. Жерновая мельница |
. Стандартизация мазей. Мази стандартизуют по содержанию лекарственных веществ, значению рН их водных растворов (извлечений) и степени дисперсности твердых частиц в суспензионных мазях.
Однородность мазей определяется визуально по методике, включенной в ГФ XI. В связи с возросшими требованиями к качеству препаратов более прогрессивным является метод исследования мазей, разработанный профессором И. А. Муравьевым с сотрудниками. Нормы степени дисперсности твердых частиц являются индивидуальными для каждой мази, например, по фармакопее ГДР не более 60 мкм, в глазных мазях-не более 10 мкм. Предлагается оценивать также кристалличность лекарственных веществ с помощью оптического микроскопа.

| 
|
| Рис. 21.4. Принцип работы трехвальцовой мазетеркп. 1 - салки; 2 ~ бункер; 3 - направляющий желоб. | Рис. 21.5. Устройство РПА с внешней циркуляцией в замкнутом цикле. 1 - мазеоой кого; 2 - паровая pvGainvsa; 3 - двигатель; 4 - РИЛ |
Значительное влияние на терапевтическую ценность мази и ее стойкость при хранении оказывают структурно-механические свойства, характеризующие консистенцию, которая в настоящее время не измеряется, отсюда возможен выпуск нестандартной продукции. В связи с этим проводятся исследования по разработке методов определения растекаемости мази, коллоидной стабильности и др.
Фасовка и хранение мазей. Мази фасуют а стеклянные банки, полиэтиленовые и алюминиевые тубы. Металлические тубы изнутри покрывают лаком для консервной тары, снаружи - эмалевой краской. Упаковку в тубы осуществляют с помощью тубонабивоч-ных полуавтоматов.
Хранят мази в прохладном, защищенном от света месте. '
Номенклатура мазей разнообразна. Примерами-мазей, выпускаемых фармацевтическими предприятиями, могут быть следующие.
Мазь ртутная белая (Unguentum Hydrar-gyri album). Состав: ртути амидохлорида мельчайшего порошка 10,0 г, вазелина 60,0 г, ланолина 30,0 г.
Мазь с йодидом калия (Unguentum-Kalii jodidi). Состав: калия йодида 50,0 г, натрия тиосульфата 1,0 г, воды дистиллированной 44,0 г, ланолина безводного 135,0 г, эмульсионной основы 270,0 г (вазелина 162,0 г, эмульгатора Т-2 или № 1 27,0 г, воды 81,0 г).
Паста салицилово-цинковая (Pasta Zinci salicylatum). Состав: кислоты салициловой мельчайшего порошка 2,0 г, цинка оксида 25,0 г, вазелина желтого 48,0 г.
Мазь амиказоловая 5% (Unguentum Amycazoli 5%). Состав: амиказола 5,0 г, моно-зтилового эфира этиленгликоля 4,5 г, ланолина безводного 10,0 г, эмульгатора Т-2 20,0 г, спирта коричного 0,15 г, натрия тетрабората 1,5 г, воды 48,85 г.
Мазь «У н д е ц и и» (Unguenturn «Undecinum»). Состав: кислоты ундециленовой 8,0 г, меди унде-циленовокислой 8,0 г, парахлорфенилового эфира глицерина 4,0 г, эмульгатора № 1 7,0 г, этилцеллюло-зы 4,0 г, воды дистиллированной до 100,0 г.
Контрольные вопросы
1. Какова технология мазей?
2. В чем заключается гомогенизация мазей и в каких случаях она является обязательной?
3. По каким показателям стандартизуют мази?
4. Какое оборудование используется в производстве мазей?
5. В чем преимущества РПА перед другими машинами в производстве суспензионных мазей?
6. Приведите примеры мазей промышленного производства. Каковы особенности их технологии?
Глава 22
ПЛАСТЫРИ (EMPLASTRA). ГОРЧИЧНИКИ (S1NAPISMATA)
ПЛАСТЫРИ
Пластыри - лекарственная форма для наружного применения, обладающая способностью после размягчения при температуре тела прилипать к коже. Они легко удаляются с нее, не оставляя следа. Это одна из старейших лекарственных форм, включенная во все фармакопеи мира. В настоящее время номенклатура пластырей и их назначение чрезвычайно разнообразны.
В состав пластырей могут входить смолы, парафин, воск, соли высших жирных кислот (мыло свинцовое), жиры, каучук, соли смоляных кислот (цинка резинат), ланолин, вазелин, церезин, летучие растворители (эфир, этанол) и различные лекарственные вещества. Комбинация этих веществ придает пластырям необходимые структурно-механические свойства, обеспечивая способность постепенно размягчаться, удерживаться на коже и оказывать терапевтическое действие.
Пластыри выпускают в виде лекарственной формы, представляющей собой тонкий слой массы, нанесенной на тканевую (бумажную) подложку, или расфасованную в виде плиток, палочек, цилиндров, разлитые во флаконы жидкости, помещенные в алюминиевые тубы или аэрозольные баллоны. Кроме того, их выпускают как препараты в массе - цилиндрические или конические блоки, жидкие пластыри в бутылях.
Классифицируют пластыри по различным признакам. По агрегатному состоянию они могут быть твердые и жидкие. Твердые пластыри - плотные, немаркие при комнатной температуре и размягчающиеся, липкие при температуре тела. Жидкие пластыри (кожные клеи) - жидкости, оставляющие на коже после испарения растворителя пленку.
По степени дисперсности массы пластыри могут быть сплавами, растворами, суспензиями, эмульсиями или комбинированными системами.
В зависимости от медицинского назначения пластыри делят на эпидерм ические, эндерматические и диадерматические. Эпидерматические пластыри обладают необходимой липкостью и могут не содержать лекарственных веществ. Они применяются в качестве перевязочного материала, для укрепления повязок, сближения краев ран, скрытия дефектов кожи, ее предохранения от травматизирующих факторов внешней среды, при лечении некоторых кожных заболеваний. При наложении эпидермального пластыря вследствие прекращения транспирации, газо-, влаго- и теплообмена кожа под пластырем размягчается, усиливается местное кровообращение, улучшаются процессы рассасывания. Эндерматические пластыри в своем составе содержат лекарственные вещества (кератолитические, депилируюшие и др.) и применяются при заболеваниях кожных покровов на месте их наложения. Диадерматические пластыри содержат лекарственные вещества, проникающие через кожу и оказывающие воздействие на глубоко лежащие ткани или общее (резорбтивное) действие.
По составу масс пластыри классифицируют на смоляно-восковые, свинцовые и жидкие.
Пластыри смоляно-восковые
Основами смоляно-восковых пластырей являются сплавы парафина, вазелина, петролятума, жира со смолами (канифоль) и воском, придающие массе липкость. Исходные вещества должны быть безводными, так как в присутствии влаги масса становится маркой, а при хранении - ломкой и хрупкой.
Технология смоляио-восковых пластырей ведется аналогично общему правилу приготовления мазей - в реакторе.
Пластырь мозольный (Emplastrum ad clavos pedum). Состав: кислоты салициловой 20 частей, канифоли 27 частей, парафина 26 частей, нетролятума 27 частей.
Пластыри свинцовые
Пластыри свинцовые содержат в качестве обязательного компонента мыло свинцовое. Свинцовые мыла не обладают маркостью, легко сплавляются со смолами, восками, различными лекарственными веществами, устойчивы при хранении. Недостатком свинцовых мыл является их неипдифферентность. Родоначальником свинцовых пластырей является пластырь свинцовый простои.
Пластырь свинцовый простой (Emplastrum Plumbi simplex). Состав: масла подсолнечного SO частей, жира свиного очищенного 10 частей, свинца оксида в мельчайшем порошке 10 частей, воды дистиллированной в достаточном количестве,
В основе промышленного способа получения простого свинцового пластыря лежит реакция омыления жиров свинца оксидом в присутствии воды при температуре кипения массы в котле из нержавеющей стали или эмалированном котле с паровой рубашкой, снабженном мешалкой. Нельзя использовать медные и медно-луженые котлы.
Свинцовый глет, тщательно растертый п просеянный через мельчайшее шелковое сито, смешивают с 2 частями воды. Водную взвесь добавляют при перемешивании к расплавленным жирам. Реакционную смесь при непрерывном перемешивании выдерживают при температуре 105- 110°С, периодически добавляя горячую воду дистиллированную и следя за тем, чтобы она полностью не выкипала. Признаком выкипания воды служит спадение пены и повышение температуры, возникает опасность разложения жиров и глицерина. В процессе варки, которая длится 2-3 ч, цвет массы от красного постепенно переходит в беловато-серый.
Нагрев прекращают после того, как проба пластыря, вылитая в холодную воду, дает пластичную немаркую массу. Пластырную массу переносят в обогреваемые тестомесилки и многократно промывают теплой водой для удаления глицерина. Отмытый таким образом пластырь снова переносят в котел с паровой рубашкой и нагревают до температуры 105-П0°С до полного удаления воды. Пластырная масса считается обезвоженной, когда взятая шпателем проба тянется в виде прозрачных нитей.
На качество готового пластыря влияет качество исходных жиров. Свинца оксид не должен содержать примесей сурика, которые не омыляют жиров. Вода должна быть обязательно дистиллированная во избежание образования свинца сульфатов и карбонатов. Глицирин и промывная вода должны быть полностью удалены, иначе пластырь при хранении становится хрупким. Простой свинцовый пластырь представляет собой смесь свинцовых солей высших жирных кислот: стеариновой, пальмитиновой, олеиновой с преобладанием двух последних. Кроме того, пластырь содержит следы неомыленных жиров и не более 3% воды.
Пластырь свинцовый простой самостоятельно не применяется, он входит в состав мази свинцовой и ряда пластырей.
Пластыри, в состав которых наряду с другими лекарственными веществами входит пластырь свинцовый простой, разделяют на свинцово-смоляные, среди которых выделяют пластырь свинцовый сложный, и свинцово-восковые. Из свинцово-восковых наиболее часто применяют пластырь эпилиновый.
Пластырь свинцовый сложный (Ет-plastrum Plumbi composiium). С о с т а в: '«пластыря свинцового простого 85 частей, канифоли 10 частей, масла терпентинного 5 частей. 4
Пластырь свинцовый и канифоль сплавляют полуостывшей массе при постоянном перемешивании добавляют скипидар. Из плстырной массы выдавливают или выкатывают палочки. Применяют как легкое раздражающее средство при гнойно-воспалительных заболеваниях кожи, фурункулах как вытяжное средство.
Пластырь эпилиновый 4% (Emplastrum Epilini 4%). Состав: этшлнна 4 части, пластыря свинцового простого 54 части, воска 5 частей, ланолина безводного 22 части, воды 15 частей.
Пластырь свинцовый простой сплавляют с воском и ланолином безводным. Сплав фильтруют через си то № 3 в бачок с мешалкой. Эпилин растворяют в воде дистиллированной при слабом нагревании. Рас твор эмульгируют в теплом сплаве до полного охлаж дения массы. Пластырь оказывает эпилирующее действие, применяют для удаления волос при лечении грибковых заболеваний волосистой части головы Хранение: список Б.
Каучуковые пластыри
. Каучуковые пластыри изготавливают на основе синтетического и натурального невулканизированного каучука. Каучук не раздражает кожу, индифферентен в отношении многих лекарствен






