Для студентов очной, очно-заочной и заочной форм обучения
Часть 1
Направления подготовки: 06.03.01Биология, 19.03.01 Биотехнология
Тула
Издательство ТулГУ
2016
Методические указания по выполнению лабораторных работ по дисциплинам «Микробиология с основами вирусологии» и «Микробиология» для студентов очной, очно-заочной и заочной форм обучения. Часть 1/ составили: М. А. Чепурнова, Е. В. Акатова, И. А. Нечаева – Тула: Изд-во ТулГУ, 2016. – 119 с.
ISBN
В методических указаниях приведены 25 лабораторных работ, выполнение которых будет способствовать усвоению студентами теоретического материала по курсам «Микробиология с основами вирусологии» и «Микробиология».
Печатается по решению библиотечно-издательского совета Тульского государственного университета.
© М. А. Чепурнова,
Е. В. Акатова
И. А. Нечаева, 2016.
ISBN © Издательство ТулГУ, 2016
Оглавление
РАЗДЕЛ 1: ОСНОВНЫЕ ПРАВИЛА РАБОТЫ В МИКРОБИОЛОГИЧЕСКОЙ ЛАБОРАТОРИИ 5
Лабораторная работа №1. 5
Устройство микробиологической лаборатории. 5
Правила работы в ней. 5
Лабораторная работа № 2. 11
Методы стерилизации. 11
Лабораторная работа № 3. 21
Микроскоп и техника микроскопирования. Устройство микроскопа. Виды микроскопии 21
Лабораторная работа № 4. 32
Морфология бактерий, цианобактерий, дрожжей и мицелиальных грибов 32
Лабораторная работа № 5. 43
Приготовление фиксированных препаратов микроорганизмов. Простые и дифференцированные методы окрашивания. Окраска бактерий по Граму. 43
Лабораторная работа № 6. 51
Исследование микроорганизмов в живом состоянии. 51
Лабораторная работа № 7. 54
Споры бактерий. 54
РАЗДЕЛ 3: ПРИГОТОВЛЕНИЕ ПИТАТЕЛЬНЫХ СРЕД.. 59
Лабораторная работа № 8. 59
Питательные среды для культивирования микроорганизмов. Приготовление питательных сред различного состава 59
Лабораторная работа № 9. 66
Значение отдельных элементов питания в развитии микроорганизмов. 66
РАЗДЕЛ 4: КУЛЬТИВИРОВАНИЕ МИКРООРГАНИЗМОВ.. 70
Лабораторная работа № 10. 70
Культивирование анаэробных микроорганизмов. 70
Лабораторная работа № 11. 74
Выделение чистой культуры бактерий. 74
Лабораторная работа № 12. 81
Фазы роста микробиологических культур и расчет кинетических параметров роста 81
РАЗДЕЛ 5: МЕТОДЫ КОЛИЧЕСТВЕННОГО УЧЕТА МИКРООРГАНИЗМОВ 108
Лабораторная работа № 13. 108
Методы количественного учета микроорганизмов. Определение количества клеток микроорганизмов высевом на плотные питательные среды (метод Коха) 108
Лабораторная работа № 14. 113
Методы количественного учета микроорганизмов.Определение количества клеток микроорганизмов под микроскопом 113
Литература. 118
РАЗДЕЛ 1: ОСНОВНЫЕ ПРАВИЛА РАБОТЫ
В МИКРОБИОЛОГИЧЕСКОЙ ЛАБОРАТОРИИ
Лабораторная работа №1
Устройство микробиологической лаборатории.
Правила работы в ней
Цель работы: познакомиться с устройством микробиологической лаборатории, основным оборудованием, правилами работы.
Основные положения
Биологические процессы имеют свою специфику. Они осуществляются с использованием различных биологических систем, включая как живые организмы (микроорганизмы), так и их компоненты (ферменты, их комплексы и др.). При этом микробиологи используют, как правило, чистые культуры микроорганизмов (т.е. культуры, содержащие микроорганизмы одного вида), а принцип асептики любого микробиологического процесса является одним из основных. В связи с чем, требование чистоты используемых культур и соблюдение условий стерильности в работе в значительной степени определяет специфику устройства микробиологической лаборатории и правила работы микробиолога.
Современная микробиологическая лаборатория представляет собой комплекс помещений, оборудования и приборов, позволяющих использовать различные приемы для выращивания микроорганизмов, выделения их чистых культур, изучения морфологических, культуральных и физиолого-биохимических свойств.
Микробиологическая лаборатория должна включать ряд помещений. Основная лабораторная комната должна быть просторной и светлой. Естественное освещение должно составлять не менее 110 лк. Пол и поверхность всех рабочих столов покрывают легко моющимся материалом. Стены на высоту не менее 170 см окрашивают в светлые тона или облицовывают плиткой. Такая отделка позволяет проводить влажную уборку с применением растворов дезинфицирующих веществ. Лабораторные столы должны иметь подводку электроэнергии быть снабжены газовыми горелками. Помещение должно быть оборудовано шкафами и полками для хранения аппаратуры, посуды и реактивов. Кроме основного рабочего помещения лаборатория должна иметь стерилизационную, термостатированную комнату, холодильную комнату, моечную и др. В стерилизационной размещают автоклавы и сушильные шкафы. В термостатированной комнате выращивают микроорганизмы. В некоторых лабораториях из-за недостатка площадей используют термостаты различного типа для культивирования микроорганизмов при постоянной температуре. Вместо холодной комнаты используют холодильник и морозильную камеру.
Работу с микроорганизмами и культурами клеток осуществляют в боксах различных конструкций от изолированных помещений до настольных камер (ламинаров). Бокс – специальное изолированное помещение, разделенное на две части: рабочее помещение и предбоксник, что исключает резкую циркуляцию воздуха и занесение микроорганизмов извне. В боксе устанавливают стол, стулья, на стены подвешивают бактерицидные лампы на высоте 2 м от пола. Перед работой помещение бокса моют и дезинфицируют, а после влажной уборки в течение 30-60 мин проводят стерилизацию воздуха бактерицидными лампами.

Рисунок 1. Инструменты и посуда, используемые в микробиологической лаборатории:
1 - качалочная колба, 2 - качалочная колба с отбойниками, 3 - чашка Петри, 4 - пробирка биологическая, 5 - колбы плоскодонные конические Эйлермейера, 6 – матрац, 7 – пробирки с поплавками, 8 – мерные цилиндры, 9 – предметное стекло, 10 – покровное стекло, 11 – камера Гаряева, 12 – поплавки (пробирки Уленгута), 13 – микробиологическая игла, 14 – микробиологическая петля, 15 – шпатель Дригальского, 16 – пипетки Мора, 17 – мензурка, 18 – пипетки Пастера, 19 – пипетки градуированные, 20 –пипетка автоматическая.
Посуда и инвентарь для проведения микробиологических исследований. Для микробиологических исследований необходима различная стеклянная посуда (рис. 1). Чашки Петри (диаметр 10 см, высота 1,5 см) применяют для выделения чистых культур, количественного учета микроорганизмов, анализа качественного состава микрофлоры на плотных питательных средах и других исследований; стеклянные поплавки - для изучения процессов брожения; пробирки биологические – для хранения чистых культур и проведения микробиологических исследований; пастеровские пипетки с оттянутым капилляром. Кроме специальной посуды широко используют обычную химическую посуду: колбы плоскодонные конические Эйлермейера, круглодонные, мерные, градуированные пипетки, пипетки Мора, мензурки, мерные цилиндры, бюксы, склянки и т.д. Колбы и пробирки, используемые для приготовления и стерилизации питательных сред и выращивания микроорганизмов, закрывают ватно-марлевыми пробками, которые изготовляют вручную или при помощи специальной машины. Правильно изготовленная пробка для пробирок должна иметь длину 3-4 см, умеренно туго входить в пробирку, быть плотной и не менять своей формы при многократном применении.
В микробиологической практике применяют петли, иглы, пинцеты, ножницы, пластмассовые и металлические штативы для пробирок, металлические лотки и др. Петли и иглы изготовляют из платиновой, никелевой или хромоникелевой проволоки и закрепляют в металлическом петледержателе.
При работе в лаборатории микробиологии студент должен соблюдать следующие правила:
1. При работе в лаборатории с бактериологическим материалом необходимо тщательно соблюдать правила личной и общественной безопасности при ее выполнении.
2. Каждый студент должен работать на постоянном месте.
3. Рабочее место должно быть свободно от лишних предметов (сумок, портфелей).
4. Во время работы с горелкой или спиртовкой рядом не должно находиться легко воспламеняющихся материалов.
5. Работа выполняется в чистом халате. Длинные волосы должны быть собраны во избежание попадания в пламя горелки (спиртовки).
6. На каждом занятии назначаются дежурные, которые следят за порядком и за выполнением каждым студентом правил работы и поведения в лаборатории;
7. Посуда, в которой производится посев и культивирование микроорганизмов, должна быть подписана (дата посева, культура, группа или студент, производивший посев).
8. Предметы, которые использовались для работы с живыми культурами, должны быть обеззаражены либо обжиганием в пламени горелки, либо выдерживанием в дезинфицирующем растворе (пипетки, шпатели, микробиологические иглы и петли, покрывные и предметные стекла).
9. Все засеянные чашки Петри, пробирки помещаются в термостат или сдаются лаборанту.
10. Обработанный материал помещается в автоклав для обеззараживания.
11. В лаборатории строго запрещается прием пищи.
12. По окончании занятия студент должен:
а) привести в порядок рабочее место;
б) сдать дежурному весь материал и микроскоп;
в) вымыть руки с мылом, при необходимости с дезинфицирующим раствором.
Задание.
1. Познакомиться с правилами работы в микробиологической лаборатории, отметиться в журнале инструктажа по технике безопасности в лаборатории.
2. Познакомиться с устройством микробиологической лаборатории, выделить основные зоны: рабочую, стерилизационную, термостатированную, холодную, моечную.
3. Познакомиться с основным оборудованием лаборатории, сделать описание в лабораторной тетради.
Контрольные вопросы
1. В чем заключается основной принцип любого микробиологического процесса?
2. Что определяет специфику устройства микробиологической лаборатории и правила работы микробиолога?
3. Какие помещения должна включать микробиологическая лаборатория?
4. Какие требования предъявляют к основной лаборатории?
5. Что размещают и для чего предназначены холодная, термостатированная и стерилизационная комнаты?
6. Что такое бокс?
7. Какой специфической посудой пользуются микробиологи?
8. Перечислите основные правила работы в лаборатории микробиологии.
Лабораторная работа № 2
Методы стерилизации
Цель работы: изучить основные методы стерилизации питательных сред, стеклянной посуды, инструментов и приборов.
Материалы и оборудование: стерилизатор паровой, сухожаровой шкаф. Колбы, пробирки, микробиологические петли, вата, марля, спирт.
Основные положения
Стерилизация (от лат. sterilis – обеспложивание) – методы, применяемые для уничтожения всех форм жизни как на поверхности, так и внутри стерилизуемых объектов. Стерилизуют питательные среды, посуду, различные инструменты и другие необходимые предметы с целью не допустить развитие посторонних микроорганизмов в исследуемых культурах. Если стерильная среда или микробная культура загрязняется случайно попавшими в нее микроорганизмами, то говорят о контаминации, или загрязнении.
Способы стерилизации зависят от особенностей материала, подлежащего стерилизации и цели исследования. Выделяют следующие способы стерилизации сред, посуды и инструментов:
1. Термическая стерилизация
1.1. Стерилизация в пламени горелки
Мелкие металлические инструменты: петли, иглы, пинцеты, ножницы, шпатели – стерилизуют прокаливанием в пламени (нагреванием докрасна) непосредственно перед использованием. На пламени кратковременно обжигают предметные и покровные стекла, стеклянные шпатели и палочки, фарфоровые ступки и пестики, горлышки колб, пробирок, бутылок, а также ватные пробки при пересевах культур и разливах сред. В пламени погибают и вегетативные клетки, и споры микроорганизмов.
Петли делают из нихромовой или платиновой проволоки, чтобы при прокаливании на них не появлялась окалина. Если петля сухая, то ее в вертикальном положении вносят в верхнюю, самую горячую часть пламени и прокаливают до красного каления сначала ее нижнюю, а затем верхнюю часть. Если на петле находится какой-нибудь материал, то петлю в горизонтальном положении вносят в нижнюю, самую холодную часть пламени (если внести в горячую часть, то может произойти разбрызгивание материала), и только после того, как материал полностью сгорит, продолжают прокаливание в верхней – горячей части пламени.
1.2. Стерилизация сухим жаром
Обработка сухим горячим воздухом проводится в специальных суховоздушных (сухожаровых) стерилизаторах и сушильных шкафах, приспособленных для стерилизации. Стерилизуют стеклянную посуду: чашки Петри, колбы, пробирки, пипетки и т.д., которые предварительно заворачивают в бумагу для сохранения стерильности после прогревания. Посуду развертывают непосредственно перед употреблением. При этом погибают и вегетативные клетки, и споры микроорганизмов. Температурные режимы стерилизации сухим жаром представлены в таблице 1.
Таблица 1. Условия стерилизации стеклянной посуды сухим жаром
| Температура, °С | Время, мин |
| 140 | 180 |
| 150 | 150 |
| 160 | 120 |
| 170 | 60 |
При нагреве выше 180 °С бумага и пробки начинают обугливаться. Посуду вынимают, предварительно охладив ее до 50-70 ° С, поскольку нагретое стекло может растрескаться.
1.3. Стерилизация автоклавированием
Это наиболее надежный и чаще всего применяемый способ стерилизации питательных сред. Основан на нагревании материала насыщенным водяным паром при давлении выше атмосферного. Совместное действие высокой температуры и пара обеспечивают эффективность этого процесса. При этом погибают и вегетативные клетки, и споры микроорганизмов. Установлено, что споры большинства микроорганизмов не выдерживают и 5-минутную экспозицию в насыщенном паре при 121 °С и лишь споры некоторых почвенных бактерий погибают при этой температуре только через 30 мин. Температурные режимы автоклавирования представлены в таблице 2.
Стерилизацию осуществляют в специальных герметически закрывающихся толстостенных аппаратах – автоклавах.
Таблица 2. Температура насыщенного пара при разных давлениях
| Давление | Температура, °С | ||
| атм | ати | кПа | |
| 1,0 | 0,0 | 101,32 | 100 |
| 1,5 | 0,5 | 151,98 | 111 |
| 2,0 | 1,0 | 202,65 | 121 |
| 2,5 | 1,5 | 251,20 | 128 |
| 3,0 | 2,0 | 299,75 | 134 |
Автоклав представляет собой металлический двустенный котел (рис. 2), способный выдерживать высокое давление. Внутренняя часть котла – стерилизационная камера, в которую помещают стерилизуемый материал (питательные среды, посуда, рабочая одежда и т.д.). Она окружена водопаровой камерой, которая имеет кран для выхода воздуха и пара. Пар в стерилизационную камеру подается через специальные отверстия в водопаровой камере. Давление регулируется с помощью манометра. Внутрь стерилизационной камеры помещают стерилизуемые предметы (не слишком плотно). В водопаровую камеру через специальную воронку наливают дистиллированную воду до необходимого уровня. Крышку закрывают герметически при помощи специальных винтов.
Среды, содержащие сахара, витамины, дрожжевой автолизат и среды с желатином стерилизуют при давлении 1,5 атм в течение 15-30 мин. Среды, содержащие агар, стерилизуются труднее, поэтому их стерилизуют при 2,0 атм 20 мин.
1.4. Пастеризация
Однократный прогрев материала при температуре ниже 100 °С. Метод был предложен Л. Пастером и предназначен для уничтожения только бесспоровых форм микроорганизмов. Проводится нагреванием до 50-60 0С в течение 15-30 мин. или до 70-80 0С в течение 5-10 мин с последующим охлаждением до 10-11 °С. Далее продукты хранят в холодильнике, т.к. споры при таком способе стерилизации выживают. Метод используют в пищевой промышленности для обработки молока, фруктовых соков, вина, пива и др.

Рисунок 2. Стерилизатор паровой ВК-75-01. Схема автоклава:1 - кожух, 2 - вентиль для заполнения автоклава водой, 3 - камера водопаровая, 4 - колонка водоуказательная для заполнения автоклава водой, 5 - вентиль для слива воды из автоклава, 6 - воронка для заполнения автоклава водой, 7 - камера стерилизационная, 8 - крышка, 9 - прижим, 10 - манометр электроконтактный измеряет давление в водопаровой камере, 11 - манометр измеряет давление в стерилизационной камере, 12 - вентиль для поступления пара в стерилизационную камеру, 13 - вентиль для удаления пара из стерилизационной камеры.
1.5. Тиндализация (дробная стерилизация)
Дробная стерилизация была предложена Джоном Тиндалем. Применяется для сред, не выдерживающих температуру выше 100 °С. Ее осуществляют текучим паром в автоклаве с незавинченной крышкой при открытом кране для выпуска пара или в специальном аппарате. Стерилизация проводится дробно: по 20-30 мин. в течение нескольких дней для уничтожения вегетативных клеток, проросших из спор. В промежутках между стерилизацией среды ставят в термостат при температуре 30 ° С на 8-12 ч для прорастания жизнеспособных спор.
1.6. Кипячение
Некоторые предметы (металлические инструменты, мелкие стеклянные детали, мембранные фильтры) можно стерилизовать длительным (20-30 мин.) кипячением в дистиллированной воде. Для этого используют специальные закрытые сосуды – стерилизаторы. Надежность стерилизации при кипячении можно увеличить внесением в воду бактерицидного средства (2% формальдегида и др.).
2. Холодная стерилизация
2.1. Стерилизация фильтрованием
Стерилизуют синтетические среды строго определенного состава, которые содержат легкоразрушающиеся или летучие компоненты – витамины, аминокислоты, белки, ароматические углеводороды, антибиотики и др. Фильтрование жидкостей осуществляют через мелкопористые материалы, легко адсорбирующие клетки микроорганизмов: асбест, целлюлозу, фарфор, каолин и т.д.
Широко используются мембранные фильтры – диски разного размера, диаметра, напоминающие бумажные. Их изготавливают на основе нитроцеллюлозы. Средний диаметр пор фильтров составляет 0,35-1,2 мкм. Для стерилизации, как правило, используют фильтр с диаметром пор 0,35 -0,45 мкм. Фильтры Зейтца – плотные диски, изготовленные из смеси асбеста с целлюлозой (средний диаметр пор 0,8 – 1,8 мкм).
Мембранные фильтры стерилизуют автоклавированием при 2 атм 15 мин.
2.2. Стерилизация газообразными веществами
Стерилизуют аппаратуру, имеющую зеркальное, оптическое оборудование, изделия из термолабильных пластмасс. Для этого применяют соединения, которые обладают спороцидными свойствами – оксид этилена, метилбромид, формальдегид, озон и др.
Газовую стерилизацию проводят в специальных герметически закрывающихся аппаратах. При стерилизации строго контролируют концентрацию газа, давление, влажность, температуру и длительность экспозиции. Часто процесс проводят в сочетании с некоторым повышением температуры (до 45-70 ° С). По окончании стерилизации удаляют газы из аппарата, а использование предметов, простерилизованных газами, можно не ранее чем через 24 ч (необходимо для полного удаления из них газов).
2.3. Стерилизация облучением
Для стерилизации помещений, оборудования, некоторых медицинских принадлежностей, пищевых продуктов используют разные виды излучений: инфракрасное, УФ, рентгеновские лучи, α-, β-, γ-лучи радиоактивных элементов. Чаще других в микробиологической практике используют УФ облучение.
В настоящее время все большее распространение получают посуда и инструменты одноразового использования.
2.4. Химический метод стерилизации
Уничтожение (дезинфекция) микроорганизмов с помощью сильнодействующих химических веществ (антисептиков). Антисептики могут быть неорганической и органической природы. К первой группе относятся кислоты, щелочи и соли (0,1-0,2 % раствор сулемы), хлорная известь, йод. Ко второй группе - этиловый и бутиловый спирт, альдегиды, органические растворители (0,5-3 % раствор хлорамина, 1-4 % раствор формалина) и органические кислоты. Этот метод чаще всего применяется для дезинфекции рабочих поверхностей, рук, боксов.
3. Приготовление ватных пробок
Их готовят из гигроскопической ваты, поскольку она хорошо обеспечивает стерильность субстрата и не сильно тлеет. Для изготовления пробки (рис. 3) берут прямоугольный кусочек ваты, загибают его края и сворачивают плотным валиком, примеривая его к горлышку пробирки или колбы. Проверить качество пробок: хлопок в момент открывания пробирки, очень твердая (“каменная”) на ощупь.
Валик плотно оборачивают марлей так, чтобы вся вата была под ней, и завязывают нитками. Лишние концы марли обрезают. Пробка для пробирок должна иметь длину не более 3 см, быть достаточно плотной, хорошо сохранять свою форму и свободно входить в нее. Поверх пробки на колбу надевают бумажные колпачки, которые предохраняют ее горлышко от пыли.
Не использовать пробки, изготовленные только из ваты - они легко воспламеняются при обжигании!
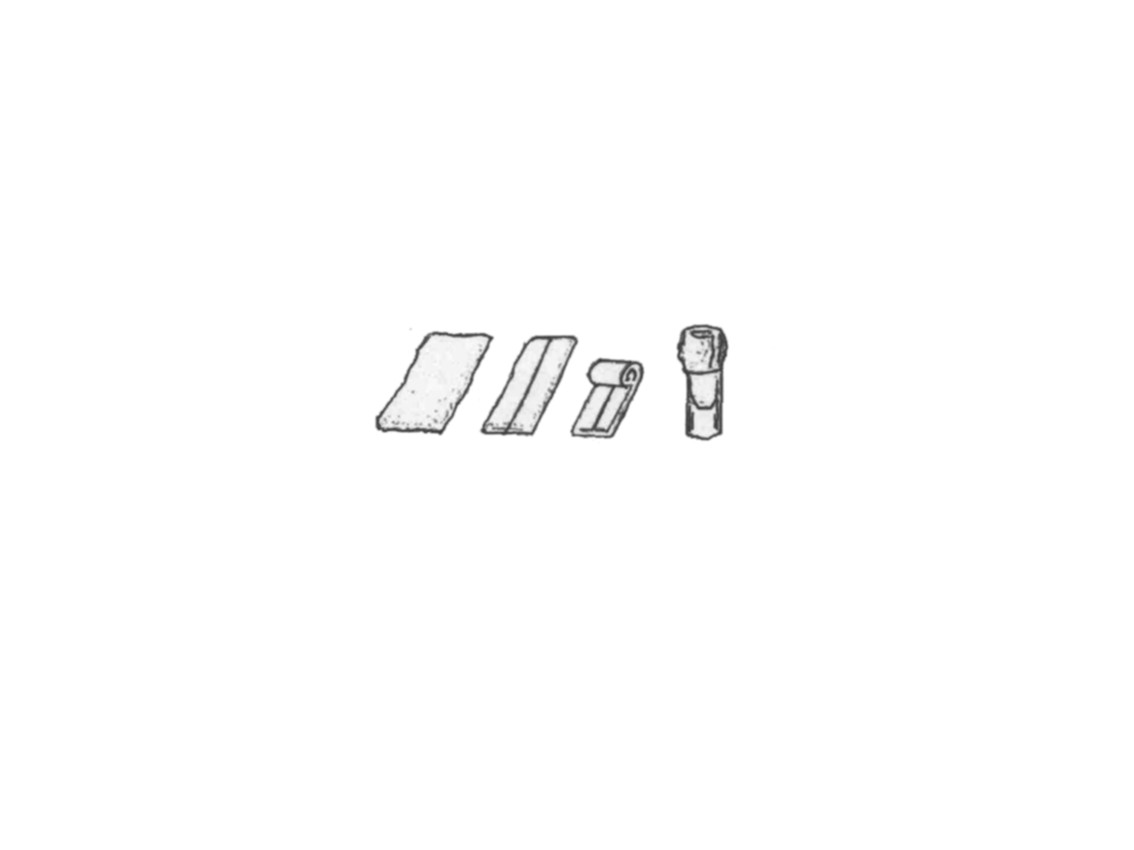 (1)
(1)
 (2)
(2)
Рисунок 3. Изготовление ватных пробок (1). Вид пробок (2): А – правильно изготовленная пробка, Б и В – не правильно изготовленная пробка
Задание:
1. Познакомиться с основными методами стерилизации.
2. Провести стерилизацию стеклянной посуды (чашки Петри, пипетки, колбы, пробирки) сухим жаром. Для этого предварительно оберните в бумагу посуду и поместите в сушильный шкаф. Режим стерилизации: 170 °С, время – 60 мин.
3. Подготовить к стерилизации 3–5 пробирок и 1–2 колбы. Для этого чистые пробирки и колбы закрывают ватными пробками, которые необходимо приготовить.
4. Провести дезинфекцию рабочих поверхностей и ламинарного бокса химическим методом, используя этиловый спирт, либо раствор хлорамина.
5. Освойте метод стерилизации в пламени горелки, используя металлические и стеклянные инструменты (микробиологические петли, пинцеты, ножницы, шпатель).
6. Нарисуйте схему устройства автоклава, отметьте его основные части.
Контрольные вопросы.
1. Какой процесс называется дезинфекцией?
2. Какие вещества используются для проведения дезинфекции?
3. Какой процесс называется стерилизацией?
4. Какими способами можно проводить стерилизацию?
5. Что и при каких условиях стерилизуют в автоклаве, в сушильном шкафу и кипячением?
6. Чем отличается тиндализация от пастеризации?
7. Какие химические вещества используют для холодной стерилизации?
РАЗДЕЛ 2: МИКРОСКОПИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ МИКРООРГАНИЗМОВ
Лабораторная работа № 3
Микроскоп и техника микроскопирования. Устройство микроскопа.
Виды микроскопии
Цель работы: изучить устройство светового биологического микроскопа и освоить правила работы с ним. Ознакомиться с различными видами микроскопии.
Материалы и оборудование: микроскоп; иммерсионное масло; препараты микроорганизмов.
Основные положения
1. Устройство микроскопа
Микроскоп (от греч. micros – малый и scopio – смотрю) – это оптический прибор, состоящий из трех основных частей: механической, оптической и осветительной. Схема светового биологического микроскопа представлена на рис. 4.
Механическая часть или штатив состоит из ножки, основания, тубусодержателя, предметного столика, бинокулярной насадки (тубуса), револьверного устройства, рукоятки грубой фокусировки (макрометрического винта), рукоятки тонкой фокусировки (микрометрического винта).
Тубус – зрительная труба микроскопа. В верхнее отверстие тубуса свободно вставляется окуляр, на нижнем конце тубуса находится вращающееся вокруг своей оси револьверное устройство (револьвер), в которое ввинчиваются объективы. Вращая револьвер, можно быстро сменить объективы во время работы с микроскопом, подводя любой объектив под тубус.
Объектив должен быть центрирован, т.е. установлен на оптическую ось микроскопа. Для этого револьвер поворачивают вокруг своей оси до появления щелчка.
Предметный столик служит для размещения на нем изучаемого препарата. Препарат закрепляют на столике зажимами (клеммами). В центре предметного столика находится отверстие для прохождения лучей света и освещения препарата. В некоторых конструкциях микроскопа предметный столик может передвигаться с помощью винтов, расположенных по периферии предметного столика. Это дает возможность рассмотреть препарат в различных полях зрения.

Рисунок 4.Схема устройства светового биологического микроскопа (Биомед 4).
Рукоятки грубой и тонкой фокусировки (макро- и микровинты) служат для перемещения тубуса вверх и вниз, что позволяет установить его на необходимом расстоянии от препарата. При вращении винтов по часовой стрелке тубус опускается, а при вращении против часовой стрелки – поднимается. При вращении макрометрического винта объектив ориентировочно устанавливается на фокус, т.е. на то расстояние от препарата, при котором он делается видимым. Оборот макровинта позволяет переместить тубус на 20 мм. Микрометрический винт служит для точной установки на фокус. Полный оборот его перемещает тубус на 0,1 мм. С микровинтом следует обращаться очень осторожно.
Оптическая часть является наиболее ценной частью микроскопа. Она состоит из объективов и окуляра.
Окуляр (от лат. oculus – глаз) состоит их двух плосковыпуклых линз, заключенных в общую металлическую оправу. Верхняя линза – глазная (увеличивающая), нижняя – собирающая. Расстояние между линзами равно полусумме их фокусного расстояния. У окуляров с большим увеличением фокус короче, поэтому меньше и длина окуляра. Между линзами имеется диафрагма, ограничивающая поле зрения и задерживающая краевые лучи света. Отечественные микроскопы снабжены тремя сменными окулярами, увеличение которых указано на корпусе окуляра (х7; х10; х15).
Объективы ввинчиваются в гнезда револьверного устройства и состоят из системы линз, заключенных в металлическую оправу. Передняя (фронтальная) линза объектива является самой маленькой и единственной, дающей увеличение. Остальные линзы в объективе только исправляют недостатки полученного изображения (явления сферической и хроматической аберрации) и называются коррекционными.
В гнезда револьверного устройства ввинчиваются четыре объектива, увеличение которых указано на корпусе объектива (х8; х20; х40; х90 или 100). Каждый объектив характеризуется своим фокусным расстоянием (расстоянием между предметным стеклом и фронтальной линзой): объектив х8 имеет фокусное расстояние около 9 мм, объектив х40 – 0,65 мм, объектив х90 – 0,15 мм.
Объективы подразделяются на сухие и иммерсионные.
При работе с сухими объективами (х8, х20, х40) между фронтальной линзой и препаратом находится воздух. В этом случае лучи света проходят среды с различными показателями преломления (покровное стекло, воздух), часть их отклоняется и не попадает в объектив.
При работе с иммерсионными объективами (х90 или х100) для устранения светорассеяния расстояние между фронтальной линзой объектива и препаратом заполняют иммерсионным (кедровым) маслом, показатель преломления лучей света которого близок к показателю преломления лучей света, проходящего через стекло.
Общее увеличение микроскопа определяется как произведение увеличения объектива на увеличение окуляра. Например, если в работе используют окуляр х15, а под тубусом находится объектив х90, то увеличение рассматриваемого с помощью микроскопа объекта составит х1350.
Осветительная часть микроскопа состоит из двухлинзового конденсора, ирис-диафрагмы и патрона с низковольтной лампочкой накаливания, питающейся через понижающий трансформатор от сети напряжения 120 - 220 В.
Конденсор служит для лучшего освещения препарата. Он собирает световые лучи в пучок и направляет их через отверстие предметного столика на препарат. С помощью рукоятки для перемещения кронштейна конденсора его можно перемещать вверх и вниз, благодаря чему меняется угол сходимости лучей и, следовательно, степень освещения объекта. Чем выше положение конденсора, тем лучше освещен препарат.
Ирис-диафрагма располагается под конденсором и служит для регулировки потока света, поступающего в конденсор. Она состоит из металлических серповидных пластинок. Расширить или сузить отверстие диафрагмы можно с помощью специального рычажка. При вращении его по часовой стрелке отверстие ирис-диафрагмы увеличивается и, следовательно, увеличивается степень освещения объекта.
При работе с иммерсионными объективами степень освещения препарата должна быть максимальной, поэтому шторку ирис-диафрагмы открывают, а конденсор поднимают в крайнее верхнее положение.
При работе с сухими объективами, как правило, рассматривают неокрашенные объекты. Для достижения контрастности конденсор опускают вниз, а отверстие ирис-диафрагмы уменьшают.
2. Правила работы с микроскопом
1. На рабочем столе микроскоп ставят тубусодержателем к себе на расстоянии 3 - 5 см от края стола;
2. Включают микроскоп в сеть и устанавливают правильное освещение;
3. На предметный столик помещают исследуемый препарат и закрепляют его клеммами;
4. Под тубус помещают нужный объектив и с помощью макро и микровинтов устанавливают фокусное расстояние. Так, при работе с иммерсионными объективами на препарат предварительно наносят каплю иммерсионного масла и осторожно поднимают столик макровинтом до соприкосновения объектива с каплей масла. Затем, внимательно смотря в окуляр, очень медленно опускают столик, до тех пор, пока не увидят изображение. Точную наводку объектива на фокус производят микрометрическим винтом. Далее, двигая предметный столик или предметное стекло, устанавливают в центр поля тот участок препарата, в котором лучше всего виден изучаемый объект.
5. После окончания работы следует убрать препарат с предметного столика, удалить мягкой тканью или марлей, смоченной в спирте, иммерсионное масло с фронтальной линзы объектива х90.
3. Виды микроскопии
Основными характеристиками микроскопа являются общее увеличение и разрешающая способность.
Общее увеличение не характеризует качества изображения, которое может быть четким и нечетким.
Четкость получаемого изображения определяется разрешающей способностью микроскопа, т.е. той наименьшей величиной объектов или их деталей, которые можно увидеть с помощью этого прибора. Разрешающая способность зависит от длины проходящего через объект света, показателя преломления оптической среды (показатель преломления воздуха равен 1,0; иммерсионного масла – 1,516; стекла –1,520) и апертурного угла объектива:

где: d – минимальное расстояние между двумя точками, видимыми раздельно;
l - длина волны света, проходящего через исследуемый объект;
n × sin a - числовая апертура;
n –показатель преломления светом оптической среды;
a - апертурный угол объектива.
На рис. 5 представлена схема, иллюстрирующая понятие апертурного угла микроскопа (стрелками обозначен ход световых лучей).

Рисунок 5. Схема, иллюстрирующая понятие апертурного угла
При использовании микроскопа, апертурный угол которого 900 (это предельный угол, для которого sina=1), минимальное расстояние между двумя точками при освещении объекта светом с длиной волны 550 нм для сухой системы составляет около 300 нм, а для иммерсионной системы – около 200 нм.
Таким образом, повысить разрешающую способность микроскопа можно путем:
- снижения длины волны света, проходящего через объект;
- использования иммерсионной системы;
- повышения апертурного угла до предельного (до 900).
3.1 Микроскопия в темном поле
Используется для исследования слишком малых и слабоконтрастных живых объектов. При микроскопии этим методом используют специальный конденсор темного поля, центр которого затемнен. Поэтому центральный пучок световых лучей не попадает в объектив и поле зрения микроскопа остается темным. Объект освещается только лучами, попадающими на него под углом. Рассеиваясь на объекте, часть лучей изменяет направление и попадает на объектив. Объект становится видимым как светящаяся точка на темном фоне. Метод темного поля позволяет получить представление о внешней форме живых неокрашенных объектов и их движении.
Микроскопия в темном поле позволяет увеличить разрешающую способность объектива примерно в 10 раз и рассматривать объекты, размеры которых находятся за пределами обычного микроскопа. Повышение разрешающей способности достигается за счет увеличения апертурного угла.
3.2.Фазово-контрастная микроскопия
Дает возможность изучать живые объекты без окраски и фиксирования. Глаз человека реагирует на изменения амплитуды световой волны (интенсивность, контрастность) и ее длины (цвет), но не воспринимает различий по фазе. В биологических препаратах чередуются места, которые в разной степени поглощают свет. Проходя через них, световые волны изменяют свою амплитуду. Такие участки объекта называют амплитудными, и под микроскопом они выглядят более темными. Прозрачные в видимом свете структурные элементы объектов пропускают лучи одинаковой длины и амплитуды, но смещают их фазу. Величина смещения зависит от толщины и показателя преломления структур, но видимых изменений практически не дает. Такие препараты являются неконтрастными.
С помощью фазово-контрастного устройства фазовые изменения световых волн, проходящих через прозрачные объекты, превращаются в амплитудные, благодаря чему детали рассматриваемых объектов становятся видимыми и контрастными.
Фазово-контрастное устройство дает возможность изучать структуры клеток: жгутики и оболочки бактерий, ядра и митохондрии дрожжей и грибов.
Таким образом, хотя разрешающая способность при использовании фазово-контрастной микроскопии не меняется при сравнении со светопольной, качество изображения улучшается за счет повышения контрастности.
3.3 Люминесцентная микроскопия
Люминесцентная микроскопия позволяет изучать клетки в живом виде, выявлять мембранные структуры и получать высококонтрастные цветные изображения микроорганизмов.
Сущность явления люминесценции заключается в том, что некоторые молекулы структурных элементов клетки (пигменты, витамины, алкалоиды и др.) способны поглощать часть энергии падающего света определенной длины волны, переходить в электронно-возбужденное состояние и испускать свет с другой длиной волны. Источником возбуждения могут быть ультрафиолетовые лучи (300-400 нм) и видимый свет коротковолновой области спектра (400-460 нм).
Клетки микроорганизмов обладают слабой собственной (первичной) люминесценцией. Ее можно усилить предварительным окрашиванием препаратов нетоксическими красителями – флуорохромами (акридин оранжевый, нейтральный красный, аурамин, флуоресцин и др.). В результате возникает вторичная люминесценция. Для ее возбуждения достаточно использовать сине-фиолетовую часть спектра. В результате возникает высококонтрастное цветное изображение рассматриваемого объекта.
Таким образом, при использовании люминесцентной микроскопии разрешающая способность микроскопа возрастает по сравнению со светопольной микроскопией за счет уменьшения длины волны проходящего через объект света.
3.4 Электронная микроскопия
Максимальная разрешающая способность оптических микроскопов составляет около 0,2 мкм и зависит от длины волны используемых лучей света. Увеличить разрешение в 100 и более раз можно, если вместо световых или ультрафиолетовых лучей применять поток движущихся электронов, обладающих волновыми свойствами (длина волны около 0,04 нм).
Поток электронов движется в безвоздушном пространстве от источника электронов (раскаленная нить вольфрамовой пушки) по направлению к флуоресцентному экрану и вызывает равномерное свечение его. Если же на пути электронов поместить какой-либо объект, то в зависимости от его плотности электроны будут больше или меньше задерживаться, а соответствующие места на экране окажутся более или менее затемненными. Этот простой принцип работы современного электронного микроскопа дополнен принципом отклонения электронных лучей в магнитном поле подобно тому, как световые лучи отклоняются увеличивающими стеклянными линзами. При этом используются электромагнитные линзы.
Высокая разрешающая способность современных электронных микроскопов позволяет наблюдать и изучать объекты, невидимые в оптических микроскопах: вирусы и фаги, микоплазмы, строение клеток прокариотов и эукариотов, их макро- и микроструктурные элементы. Препараты для электронной микроскопии готовят в виде очень тонких срезов на специальных ультрамикротомах или на тончайших пленках – подложках из коллодия. Следовательно, в электронных микроскопах микроорганизмы исследуют не в живом состоянии, а в виде фиксированных препаратов.
Задание
1. Познакомиться с устройством светового микроскопа и правилами работы с ним, видами микроскопии, основными особенностями их устройства и принципами их работы.
2. Зарисовать микроскоп и отметить основные части.
3. Записать технику работы с иммерсионным объективом.
4. Посмотреть препарат микроорганизмов под микроскопом с использованием иммерсионного объектива
Контрольные вопросы
1. Перечислите основные части светового микроскопа.
2. Что входит в механическую, оптическую и осветительную части микроскопа?
3. Перечислите правила работы с микроскопом.
4.Какие виды микроскопии выделяют?
5. Что такое разрешающая способность микроскопа?
Лабораторная работа № 4






