Рассмотрим равновесие, устанавливающееся на границе малорастворимый электролит (кристаллический или аморфный) – насыщенный раствор этого соединения:

насыщ. р-р насыщ. р-р
В водных растворах все малорастворимые электролиты не ассоциированы. Другими словами, средняя стадия написанного равновесия отсутствует, равновесие упрощается:
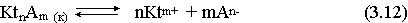
Соответствующая константа равновесия с учетом того, что концентрация индивидуального кристаллического вещества равна единице, принимает вид:
Кравн = [Ktm+]n[An-]m = произведение растворимости (ПР). (3.13)
Таким образом, произведение растворимости (ПР) есть константа равновесия растворения и диссоциации малорастворимого электролита. Оно численно равно произведению концентраций (активностей) ионов в степенях стехиометрических коэффициентов в насыщенном водном растворе данного малорастворимого электролита.
Пусть при данных условиях растворимость электролита равна Р моль/л. Тогда в соответствии с равновесием (3.12) равновесные концентрации ионов в насыщенном растворе будут равны:
[Ktm+] = nP; [An-] = mP.
Подставляем эти значения в выражение (3.13):
ПР = [Ktm+]n[An-]m = (nP)n(mP)m = nnmmPn+m.
И, наконец, находим выражение, связывающее величину ПР с растворимостью данного малорастворимого электролита:
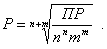 (3.14)
(3.14)
Поскольку величина ПР представляет собой константу равновесия (3.12), то ее значение легко может быть найдено по термодинамическим данным на основе следующих соотношений и величин:
DG0процесса = –RTlnПР =
= nDG0обрKtm+ (р-р, ст.с) + mDG0обрAn-(р-р, ст.с) – DG0обрKtnAm(к) (3.15)
Обратимся теперь к следующей проблеме. Пусть слили растворы, содержащие катионы Ktm+ и анионы An-, могущие образовывать малорастворимое соединение. Необходимо определить – выпадет или нет осадок и каково условие выпадения осадка?
Для того чтобы соединение выпало в осадок, необходимо, чтобы энергия Гиббса процесса (3.11) была положительна. Согласно соотношению (2.11) получаем для указанного процесса:
DG = –RTlnКравн + RTln[Ktm+]n[An-]m = –RTlnПР + [Ktm+]n[An-]m,
где [Ktm+]n[An-]m = ПК.
Под знаком логарифма стоят концентрации ионов, которые должны быть в гипотетическом растворе, полученном смешением растворов, содержащих ионы Ktm+ и An-, и в котором эти ионы не взаимодействуют. Стоящее под знаком логарифма произведение называют " произведение концентраций " (ПК), по форме оно совпадает с выражением ПР. Для выпадения осадка должно выполняться условие DG> 0, отсюда получаем:
(–RTlnПР + RTlnПК) > 0;
RTlnПК >RTlnПР;
ПК > ПР. (3.16)
Соотношение (3.16) и выражает условие выпадения осадка. Очевидно, что условием растворения осадка будет соотношение ПК < ПР, а равенство ПК=ПР соответствует состоянию равновесия между малорастворимым соединением и его насыщенным раствором.
В соответствии с принципом Ле Шателье введение одноименного иона в равновесную систему (3.11) ведет к смещению равновесия влево, то есть к уменьшению растворимости малорастворимого электролита.






