РАБОТЫ:
ОПЫТ 1. Осаждение НМС. Метод замены растворителя (демонстрационный)
К спиртовому раствору йода прилейте воды до выпадения кристаллов йода.
Выводы:
1. Покажите строение структурной единицы спиртового раствора йода.
2. Объясните механизм осаждения йода.
3. Какая дисперсная система образовалась? Покажите строение частицы этой системы.
ОПЫТ 2. Осаждение ВМС (демонстрационный)
В три пробирки налейте по 2-3 мл раствора белка. В первую пробирку прилейте разбавленный раствор NaCl. Осаждение не происходит. В эту же пробирку прилейте сухой (абсолютный) спирт или ацетон. Наблюдайте выпадение белка. Во вторую пробирку добавьте сухой спирт, затем разбавленный раствор хлорида натрия. В третью пробирку добавьте кристаллы или концентрированный раствор хлорида натрия. Опишите наблюдения.
Выводы:
1. Каковы факторы устойчивости раствора ВМС? Назовите основной фактор.
2. Зарисуйте схему Кройта и объясните механизм высаливания белков.
ОПЫТ 3. Фракционное высаливание белков
Органические растворители вызывают обратимое осаждение белков – высаливание, которое ускоряется в присутствии электролитов. Для фракционного высаливания применяют растворы электролитов различной концентрации.
К 1 мл яичного белка для высаливания добавьте концентрированный раствор (NH4)2SO4 до появления в растворе осадка глобулина в виде отдельных тонких нитей. В эту же пробирку добавьте сухой кристаллический (NH4)2SO4 до насыщения. наблюдайте помутнение раствора за счет выпадения мелкодисперсного осадка альбумина.
Выводы:
1. На чем основано фракционное высаливание?
2. Объясните порядок осаждения белков.
ОПЫТ 4. Осаждение белков кислотами (денатурация). Действие минеральных кислот (азотной)
Реакция осаждения белков азотной кислотой распространена при клинических исследованиях мочи (проба Геллера). Эта качественная реакция также лежит в основе количественного определения белка в моче.
К 5 каплям концентрированной HNO3 прилейте 3 капли раствора белка осторожно, по стенкам пробирки, чтобы жидкости не смешивались. На границе двух жидкостей образуется осадок белков в виде небольшого белого кольца.
Выводы:
1. Каков механизм денатурирующего действия азотной кислоты?
2. Является ли процесс обратимым?
ОПЫТ 5. Осаждение белков солями тяжелых металлов. Адсорбционная пептизация
Соли тяжелых металлов (меди, свинца, ртути, серебра и др.) вызывают осаждение и частичную денатурацию белков. образующиеся осадки внутрикомплексных соединений растворяются в избытке раствора соли данного металла, образуя КДС (адсорбционная пептизация).
К 10 каплям раствора яичного белка добавьте 2 капли 10 % раствора CuSO4. Наблюдайте образование осадка. Добавьте к осадку еще 10 капель раствора CuSO4. Что происходит?
ВЫВОДЫ:
1. Каков механизм денатурации при действии соли CuSO4?
2. Напишите уравнение реакции.
3. В чем сущность явления адсорбционной пептизации?
4. Напишите формулу мицеллы полученной КДС.
ОПЫТ 6. Осаждение КДС и ВМС электролитами
В одну пробирку налейте 5 мл золя Fe(OH)3, полученного по реакции гидролиза FeCl3, а в другую – 5 мл раствора желатина.
В каждую пробирку добавьте 3-4 капли разбавленного раствора (NH4)2SO4. В первой пробирке наблюдайте помутнение.
ВЫВОДЫ:
1. Объясните, почему при добавлении раствора электролита происходит коагуляция золя и не оседает желатин.
2. Постройте мицеллу золя Fe(OH)3, полученного по реакции гидролиза.
3. Объясните механизм коагуляции золя Fe(OH)3 при добавлении электролита.
4. Сделайте вывод об устойчивости КДС и раствора ВМС.
ОПЫТ 7. Осаждение ГДС (эмульсии)
В пробирку налейте 2-3 мл молока. Затем добавьте 2-3 капли раствора СаС12, отметьте, что изменений не произошло. пробирку с молоком нагрейте на водяной бане до выпадения осадка.
ВЫВОДЫ:
1. Покажите строение эмульсии. Укажите тип эмульсии и эмульгатора.
2. Объясните, почему не наблюдается коалесценция при добавлении раствора электролита.
3. Опишите механизм «коллоидной защиты».
4. Почему при нагревании выпадает осадок?
ОПЫТ 8. Определение порога коагуляции электролита для золя Fe (OH)3, полученного по реакции гидролиза
В 5 пробирок налейте по 9 мл раствора NaCl различной концентрации, в другие 5 пробирок налейте по 9 мл растворов MgSO4 таких же концентраций. В каждую пробирку добавьте по 1 мл золя Fe(OH)3 и перемешайте. Коагуляцию наблюдайте по появлению помутнения раствора в пробирке. Смотрите в пробирку сверху: если раствор остался прозрачным – коагуляции нет (-), если помутнел – коагуляция есть (+). Результаты наблюдений занесите в табл. 29. Для каждого электролита отметьте пороговую концентрацию.
Рассчитайте для каждого электролита порог коагуляции (Ск) и коагулирующее действие.
Таблица 29
| Электролит | Концентрация электролита, моль/л | Пороговая концентрация, моль/л | Cк, моль/л | D | Ион, вызывающий коагуляцию |
| 10-6 10-5 10-4 10-3 10-2 |
ВЫВОДЫ:
1. Покажите строение мицеллы золя Fe(OH)3, полученного по реакции гидролиза.
2. Сравните коагулирующее действие NaCl и MgSO4. Какие ионы вызывают коагуляцию?
3. Объясните различия в коагулирующем действии этих электролитов.
КОНТРОЛЬНЫЕ ВОПРОСЫ:
1. Факторы устойчивости различных ДС.
2. Агрегативная и кинетическая устойчивости.
3. Методы осаждения НМС, их механизм.
4. Высаливание ВМС из растворов. Механизм. Схема Кройта. Лиотропные ряды.
5. Денатурация белков. Виды денатурации. Механизм.
6. Коагуляция КДС. Механизм. Коагулирующее действие электролитов. Порог коагуляции. Правило Шульце-Гарди.
7. Осаждение ГДС. Разрушение эмульсий.
8. Сущность явления «коллоидной защиты».
9. Сравнительная характеристика устойчивости ДС,
ОБРАЗЕЦ ОТВЕТА НА ВОПРОС:
ВОПРОС: к 10 мл отрицательного золя СаСО3 для его коагуляции необходимо добавить 10 мл 10-4 М раствора КС1 или 10 мл 10-6 М раствора А1С13. Определите порог коагуляции и коагулирующее действие каждого электролита. Поясните механизм коагулирующего действия.
ОТВЕТ:


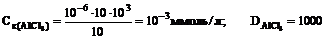
Запишем мицеллу золя СаСО3, взяв в качестве стабилизатора Na2CO3. Т.к. гранула имеет отрицательный заряд, коагуляцию вызывают К+ или А13+. Ион А13+ имеет меньший порог коагуляции, чем ион К+, что соответствует правилу Шульце-Гарди (Ск = А/Z6). Связано это с механизмом коагуляции. При добавлении электролита коагулирующие ионы (К+ или А13+) адсорбируются на грануле и нейтрализуют заряд. Ионы А13+ нейтрализуют частицу лучше, т.к. величина его заряда больше. Следовательно, для нейтрализации заряда гранулы достаточно меньшего количества ионов А13+, чем К+. При нейтрализации заряда гранулы происходит также сжатие диффузионного слоя, уменьшение ζ. Мицелла теряет свойство удерживать воду. Частицы коллоида теряют заряд (ζ → 0) и сольватную оболочку. Происходит осаждение золя.
ЛИТЕРАТУРА:
1. С. 510-523, 543-545; 3. С. 179-192; 5. С. 118-121, 126-127; 6. С. 718-727.
РАБОТА 27. РАСТВОРЫ ЭЛЕКТРОЛИТОВ.
МЕТОДЫ ОПРЕДЕЛЕНИЯ рН БИОЛОГИЧЕСКИХ ЖИДКОСТЕЙ
Представления о кислотно-основном равновесии и, в частности, протолитических реакциях необходимы врачу при изучении процессов, протекающих в биологических жидкостях живого организма.
В свете протолитической теории кислотно-основное равновесие, т.е. соотношение протонов и гидроксильных ионов в тканях организма, зависит от общего количества соединений кислотного и основного характера и степени их диссоциации в растворе. Реакция среды биологических жидкостей (желудочный сок, плазма крови, кишечный сок, слюна, моча, желчь, внутриклеточные жидкости) определяется их электролитным составом и биологической функцией жидкостей. Нарушения в деятельности органов, вырабатывающих биологические жидкости, приводят к изменениям рН последних и, наоборот, длительное смещение кислотно-основного равновесия биологических жидкостей вызывает отклонение в работе этих органов.
Лекарственные препараты, применяемые для лечения, претерпевают различные протолитические реакции в водных растворах и желудочном соке, что необходимо учитывать при назначении лекарств, а также при необходимости применения последних в капсулах. Для определения рН растворов электролитов, каковыми являются биологические жидкости организма, в клинике используют следующие методы: колориметрический и потенциометрический.
Колориметрический метод основан на сравнении окраски индикатора в исследуемой пробе с эталонной шкалой, его основное достоинство – экспрессность. Более точным и современным методом определения рН биологических сред является метод потенциометрии, суть которого состоит в измерении ЭДС гальванической цепи (рН раствора), состоящей из индикаторного и вспомогательного электродов, опущенных в исследуемый раствор. При этом различают прямую потенциометрию, позволяющую определять концентрацию свободных ионов гидроксония в водном растворе (рН), и потенциометрическое титрование, при котором устанавливается общее содержание кислых слабоионизирующих продуктов обмена. Потенциометрический метод имеет ряд преимуществ перед колориметрическим, а именно: погрешность потенциометрического титрования составляет 0,5-1%, потенциометрия позволяет проводить анализ окрашенных и мутных биологических жидкостей.
Цель занятия:
1. Овладеть практическими навыками измерения рН биологических жидкостей колориметрическим и потенциометрическим методами.
2. На основании полученных результатов произвести оценку состояния кислотно-основного равновесия исследуемых биологических жидкостей – норма, ацидоз, алкалоз.
3. Объяснить возможное смещение рН биологических жидкостей от нормы. Предложить препараты для коррекции нарушенного кислотно-основного равновесия.






