РАБОТЫ:
Определение свободного хлора в воде основано на вытеснении йода из йодидов по реакции:
Cl2 + 2KI = I2 + 2KCl
Выделившийся йод может быть оттитрован раствором Na2S2O3:
2 Na2S2O3 + I2 = 2NaI + Na2S4O6
Исследуемый раствор: водопроводная вода.
Рабочий раствор: тиосульфат натрия Na2S2O3, Сэ = 0,05 моль экв/л.
Вспомогательный раствор: 10 % раствор KI.
Индикатор: раствор крахмала.
Способ титрования: по замещению.
В коническую колбу пипеткой отмерьте 20 мл анализируемой водопроводной воды, добавьте 10-15 мл 10 % раствора KI, и титруйте выделившийся йод рабочим раствором тиосульфата натрия до соломенно-желтой окраски. Добавьте несколько капель крахмала и синий раствор дотитруйте до обесцвечивания. Титрование проводите 3 раза. Результаты должны отличаться между собой не более чем на 0,1-0,2 мл. Занесите их в табл. 22.
Таблица 22
| № опыта | V воды, мл | 
| 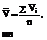
| 
| Относит. ошибка

|
| 1 | 20,0 | ||||
| 2 | 20,0 | ||||
| 3 | 20,0 |
По  определите содержание С12 в воде в г/л.
определите содержание С12 в воде в г/л.
КОНТРОЛЬНЫЕ ВОПРОСЫ:
1. Объясните, почему невозможно прямое определение С12 йодометрическим методом, если ЕоС12/2С1- = 1,36 В, ЕоI2/2I- = 0,54 В.
2. Почему при определении окислителей йодида калия берут в несколько раз больше, чем требуется по уравнению?
3. Запишите закон эквивалентов в случае титрования по замещению.
4. Назовите условия титрования при определении окислителей (температура, рН, количество вспомогательного раствора), дайте объяснения.
5. Когда добавляют индикатор при йодометрическом определении окислителей и почему?
ЛИТЕРАТУРА:
1. С. 138-139.
РАБОТА 20. ФОТОКОЛОРИМЕТРИЯ.
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ Fe (III)
В МИНЕРАЛИЗОВАННОЙ ПЛАЗМЕ КРОВИ (для лечебно-профилактического и педиатрического факультетов)
Железо по его биологической роли относится к биометаллам, а по количественному содержанию (до 5 мг в организме взрослого человека) – к микроэлементам. Содержится железо в составе гемоглобина (70%), в составе миоглобина (5-10 %), остальное – в составе Fe-содержащих белков (ферритина, трансферрина). Недостаток железа в организме приводит к анемии, избыток (сидероз) может привести к нарушению деятельности сердечно-сосудистой системы, печени, легких.
В плазме крови содержание железа в норме составляет 105 мкг% или 1050 мкг/л.
ЦЕЛЬ ЗАНЯТИЯ:
1. Ознакомиться с возможностями фотоколориметрического анализа.
2. Научиться работать на ФЭК.
3. Освоить методику приготовления проб на анализ.
4. Научиться пользоваться калибровочным графиком.
5. Научиться оценивать содержание железа (Ш) в исследуемом растворе.
ЗАДАНИЕ:
Выполните фотоколориметрическое определение содержания ионов Fe3+ в плазме крови, мкг/л, сравните с нормой, сделав вывод. Представьте отчет.






