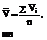РАБОТЫ:
В процессе титрования происходит реакция:
2 KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + 5O2 + K2SO4 + 8H2O
5 | H2O2 – 2e = O2 + 2H+
+ |
2 | MnO4- + 8H+ + 5e = Mn2+ + 4H2O
5H2O2 + 2MnO42- + 6H+ = 5O2 + 2Mn2+ + 8H2O
Рабочий раствор: KMnO4, Т = 1,58∙10-3 г/мл.
Вспомогательный раствор: серная кислота.
Способ титрования: прямой.
Конец титрования определяется по появлению слабо-розового окрашивания исследуемого раствора от одной сверхэквивалентной капли.
Выданную преподавателем навеску препарата «гидроперит» количественно перенесите в мерную колбу и залейте дистиллированной водой. После полного растворения препарата раствор хорошо перемешайте и долейте водой до метки, снова перемешайте. Для анализа возьмите пипеткой по 2 мл полученного раствора и перенесите в три конические колбы. Добавьте по 2 мл серной кислоты и мерным цилиндром примерно 10 мл воды. Подогрейте на электрической плитке примерно до 80оС. Оттитруйте раствором перманганата калия до появления слабо-розового окрашивания в колбе.
Титрование повторите 3-4 раза до получения сходных результатов (не отличающихся больше, чем на 0,1-0,2 мл). результаты занесите в табл. 20.
Таблица 20
| Исследуемый раствор: раствор гидроперита m навески = | |||||||
| № опыта | V иссл.р-ра, мл | VKMnO4, мл |
|
| Относит. ошибка
| Содержан. Н2О2 | |
| В мерной колбе, г | В препарате, % | ||||||
| 1 | 2,0 | ||||||
| 2 | 2,0 | ||||||
| 3 | 2,0 | ||||||
Зная титр рабочего раствора и средний объем (V) перманганата калия, рассчитайте массу пероксида водорода в объеме мерной колбы. Зная массу навески, рассчитайте массовую долю пероксида водорода в препарате «гидроперит».
КОНТРОЛЬНЫЕ ВОПРОСЫ:
1. Почему титрование по методу перманганатометрии проводят в кислой среде?
2. Почему для создания кислой среды не используют соляную и азотную кислоты?
3. Как рассчитывается эквивалент перманганата калия и пероксида водорода?
4. Какой способ титрования нужно использовать при анализе окислителей (например, KBrO3)?
5. Находит ли применением метод перманганатометрии в клинических лабораториях?
ЛИТЕРАТУРА:
1. С. 133, 227-230; 4. С. 135-142.
РАБОТА 18. МЕТОД ЙОДОМЕТРИИ.
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ АСКОРБИНОВОЙ КИСЛОТЫ В ПРЕПАРАТЕ (для лечебно-профилактического, стоматологического,
педиатрического факультетов)
Процессы дыхания, обмена веществ, проведения нервных импульсов связаны с окислительно-восстановительными реакциями в организме. Метод йодометрии дает возможность определять как окислители, так и восстановители благодаря промежуточному значению нормального потенциала ( 0,54 В). Практическое применение этот метод нашел при диагностике (определение сахара и фермента пероксидазы в крови), определении чистоты питьевой воды (остаточный хлор, бром), в анализе лекарственных форм.
0,54 В). Практическое применение этот метод нашел при диагностике (определение сахара и фермента пероксидазы в крови), определении чистоты питьевой воды (остаточный хлор, бром), в анализе лекарственных форм.
Методом йодометрии определяют чистоту препаратов–восста-новителей (анальгин, фурацилин, метионин, аскорбиновая кислота, сумма пенициллинов в солях бензилпенициллина) и препаратов-окислителей (пероксидов водорода и магния, никотиновой кислоты).
ЦЕЛЬ ЗАНЯТИЯ:
1. Ознакомиться с возможностями метода йодометрии, научиться писать уравнения реакций.
2. Научиться выбирать условия и метод титрования, рабочий раствор при определении окислителей и восстановителей.
3. Научиться решать задачи на определение веществ в растворе.
ЗАДАНИЕ:
Выполните йодометрическое определение содержания аскорбиновой кислоты в растворе. Сделайте вывод, какой препарат (пищевой, для инъекций) был дан для анализа. Напишите отчет по лабораторной работе.