Тогда период колебаний стержня
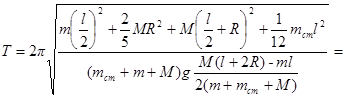
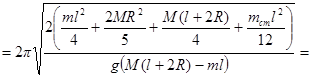
 .
.
Произведем вычисления:

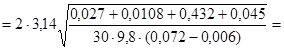
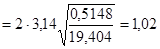 с.
с.
Ответ: Т = 1,02 с.
2. МОЛЕКУЛЯРНАЯ ФИЗИКА
ТЕРМОДИНАМИКА
Основные законы и формулы
· Количество вещества[1] тела (системы)
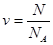 ,
,
где N – число структурных элементов (молекул, атомов, ионов и т.п.), составляющих тело (систему);
NA – постоянная Авогадро (NA = 6.02×1023 моль-1).
· Молярная масса вещества
 ,
,
где m – масса однородного тела (системы);
n – количество вещества этого тела.
· Относительная молекулярная масса вещества

где ni – число атомов i -го химического элемента, входящих в состав молекулы данного вещества;
Ari – относительная атомная масса этого вещества.
Относительные атомные массы приводятся в таблице Д. И. Менделеева.
· Связь молярной массы М с относительной молекулярной массой вещества
M=Mr ×10-3 кг/моль.
· Количество вещества смеси газов
 ,
,
где ni, mi, Mi – соответственно количество вещества, масса, молярная масса i -го компонента смеси.
· Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
 ,
,
где m – масса газа;
M – молярная масса газа;
R – молярная газовая постоянная;
n – количество вещества;
T – термодинамическая температура.
· Основные газовые законы, являющиеся частными случаями уравнения Менделеева-Клапейрона для изопроцессов:
а) закон Бойля-Мариотта (изотермический процесс: T =const, m =const) PV =const,
или для двух состояний газа P1V1=P2V2;
б) закон Гей-Люссака (изобарный процесс: P =const; m =const)
 =const,
=const,
или для двух состояний  ;
;
в) закон Шарля (изохорный процессе: V =const, m =const)
 =const,
=const,
или для двух состояний  ;
;
г) объединенный газовый закон (m=const)
 =const, или
=const, или  ,
,
где P1, V1, T1 – давление, объем и температура газа в начальном состоянии;
P2, V2, T2 – те же величины в конечном состоянии.
· Закон Дальтона, определяющий давление смеси газов:
P=P1+P2+…+Pn,
где Pi – парциальные давления компонентов смеси;
n – число компонентов смеси.
Парциальным давлением называется давление газа, которое производил бы этот газ, если бы только он один находился в сосуде, занятом смесью.
· Концентрация молекул
 ,
,
где N – число молекул, содержащихся в данной системе;
r – плотность вещества;
V – объем системы.
Формула справедлива не только для газов, но и для агрегатного состояния вещества.
· Зависимость давления газа от концентрации n молекул и температуры:
p=nkT,
где k – постоянная Больцмана ( ).
).
· Основное уравнение молекулярно-кинетической теории идеальных газов
 ,
,
или 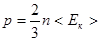 ,
,
где n – концентрация молекул;
mo – масса одной молекулы;
<  кв > – средняя квадратичная скорость молекул;
кв > – средняя квадратичная скорость молекул;
< Eк > – средняя кинетическая энергия поступательного движения молекулы газа.
· Средняя полная кинетическая энергия молекулы газа

где i - число степеней свободы молекулы. (i = iпост+iвращ)
· Скорости молекул:
а)  - средняя арифметическая;
- средняя арифметическая;
б)  - средняя квадратичная;
- средняя квадратичная;
в)  - наиболее вероятная,
- наиболее вероятная,
где mo – масса одной молекулы.
· Относительная скорость молекулы

где 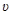 – скорость данной молекулы.
– скорость данной молекулы.
· Среднее число соударений, испытываемых молекулой газа за 1 секунду:
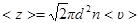 ,
,
где d – эффективный диаметр молекулы;
n – концентрация молекул;
< 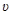 > – средняя арифметическая скорость молекул.
> – средняя арифметическая скорость молекул.
· Средняя длина свободного пробега молекул газа
 .
.
· Закон Ньютона для внутреннего трения (вязкости)
 ,
,
где F – сила внутреннего трения между движущимися слоями газа (жидкости) площадью S;
 – градиент скорости;
– градиент скорости;
h – коэффициент внутреннего трения (динамическая вязкость).
 .
.
· Молярные теплоемкости газа при постоянном объеме (CV) и постоянном давлении (CP):
 ,
,  .
.
· Связь между удельной c и молярной Cn теплоемкостями
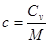 ,
,  .
.
· Уравнение Майера для молярных теплоемкостей газа
CP – CV = R.
· Внутренняя энергия идеального газа
 ,
,
где CV – теплоемкость одного моля газа при постоянном объеме.
· Первое начало термодинамики
Q = D U + A,
где Q – количество теплоты, сообщенное системе (газу) или отданное ею;
D U – изменение внутренней энергии системы;
A – работа, совершенная системой против внешних сил.
· Изменение внутренней энергии идеального газа:
 .
.
· Полная работа при изменении объема газа
 ,
,
где V1 и V2 – соответственно начальный и конечный объемы газа.
· Работа газа:
а) при изобарном процессе
 , или
, или  ;
;
б) при изотермическом процессе
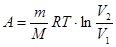 , или
, или  ;
;
в) при адиабатическом процессе
 , или
, или  ,
,
где T1, T2 и V1, V2 – соответственно начальные и конечные температура и объем газа;
 – показатель адиабаты.
– показатель адиабаты.
· Уравнение адиабатического процесса (уравнение Пуассона):
P×V g=const; T×V g-1=const; T g× P 1-g=const.
· Термический КПД для кругового процесса (цикла)
 ,
,
где Q1 – количество теплоты, полученное системой от нагревателя;
Q2 – количество теплоты, отданное системой холодильнику;
A – работа, совершаемая за цикл.
· Термический КПД цикла Карно
 ,
,
где T1 – температура нагревателя;
T2 – температура холодильника.
· Изменение энтропии при равновесном переходе системы из состояния 1 в состояние 2:
 .
.
Примеры решения задач
Пример 1. Определить для серной кислоты:
1) относительную молекулярную массу Mr;
2) молярную массу М.
Решение.
1. Относительная молекулярная масса вещества определяется по формуле  ,
,
где ni – число атомов i -го элемента, входящих в молекулу;
Аr,i – относительная атомная масса i -го элемента.
Химическая формула серной кислоты имеет вид H2SO4. Следовательно, Mr=n1Ar,1+n2Ar,2+n3Ar,3.
Из формулы серной кислоты следует, что n1 =2 (два атома водорода), n2 =1 (один атом серы) и n3 =4 (четыре атома кислорода). Значения относительных атомных масс водорода, серы и кислорода находим в таблице Д. И. Менделеева: Ar,1 =1; Ar,2 =32; Ar,3 =16.
Тогда получим: Mr =2×1+1×32+4×16=98.
2. Молярную массу серной кислоты находим по формуле:
M=Mr ×10-3 кг/моль.
Следовательно, M =98×10-3 кг/моль.
Пример 2. В баллоне объемом 10 л находится гелий под давлением p1 =1 MПа и при температуре Т1 =300 К. После того, как из баллона было взято m =10 г гелия, температура в баллоне понизилась до T2 =290 К. Определить давление p2 гелия, оставшегося в баллоне.
| Дано: | Решение: |
| V =10 л = 10-2 м3 p1 =1МПа=106Па T1 =300К m =10г=10-2кг Т2 =290К | Запишем уравнение Менделеева-Клапейрона для конечного состояния газа:
 , (1)
где m2 – масса гелия в баллоне в конечном состоянии; , (1)
где m2 – масса гелия в баллоне в конечном состоянии;
|
М – молярная масса гелия (M =4×10-3 кг/моль);
R – молярная газовая постоянная (R =8,31 Дж/моль×К).
Искомое давление:
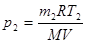 . (2)
. (2)
Массу m2 гелия выразим через массу m1, соответствующую начальному состоянию, и массу m гелия, взятого из баллона: m2=m1-m.
Из уравнения Менделеева-Клапейрона для начального состояния получаем: 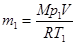 . Тогда
. Тогда  .
.
Подставив это выражение в уравнение (2), найдем:
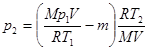 , или
, или  .
.
Произведем вычисления:


Ответ: p2 =0,364 МПа.
Пример 3. Найти среднюю кинетическую энергию <e вр > вращательного движения одной молекулы кислорода при температуре Т =350 К, а также кинетическую энергию Ек вращательного движения всех молекул кислорода массой m =4 г.
| Дано: | Решение: |
| Т =350 К m =4 г=4×10-3 кг | На каждую степень свободы молекулы газа приходится одинаковая средняя энергия 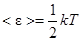 , ,
|
| <e вр >-? Ек -? |
где k – постоянная Больцмана;
Т – термодинамическая температура газа.
Так как вращательному движению двухатомной молекулы (молекула кислорода – двухатомная) соответствуют две степени свободы, то средняя энергия вращательного движения молекулы кислорода
 . (1)
. (1)
Кинетическая энергия вращательного движения всех молекул газа
Eк =<e вр >× N. (2)
Число всех молекул газа
N=NA×n =NA ×  , (3)
, (3)
где NA – постоянная Авогадро;
n – количество вещества;
m – масса газа;
М – молярная масса газа.
Подставив выражение (3) в формулу (2), получаем:
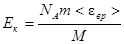 . (4)
. (4)
Произведем вычисления, учитывая, что для кислорода М =32×10-3 кг/моль; k =1,38×10-23 Дж/К; NA =6,02×1023 моль-1:
<e>=1,38×10-23×350 Дж = 4,83×10-21 Дж,

Ответ: <e вр >=4.83×10-21 Дж; Ек =364 Дж.
Пример 4. Кислород массой m =2 кг занимает объем V1 =1 м3 и находится под давлением p1 =0,2 МПа. Газ был нагрет сначала при постоянном давлении до объема V2 =3 м3, а затем при постоянном объеме до давления p3 =0,5 МПа. Найти изменение D U внутренней энергии газа, совершенную им работу А и теплоту Q, переданную газу. Построить график процесса.
| Дано: | Решение: |
| m =2 кг V1 =1 м3 p1 =0,2 МПа=2×105 Па p1 =const V2 =3 м3 V2 =const p3 =0,5 МПа=5×105 Па | Изменение внутренней энергии газа
 ,
где i – число степеней молекулы газа (для двухатомных молекул кислорода i =5);
D T=T 3– T 1 – разность температур газа в конечном (третьем) и начальном состояниях. ,
где i – число степеней молекулы газа (для двухатомных молекул кислорода i =5);
D T=T 3– T 1 – разность температур газа в конечном (третьем) и начальном состояниях.
|
| D U -? A -? Q -? p(V) -? |
Начальную и конечную температуру газа найдем из уравнения Менделеева-Клапейрона  :
:
 и
и  .
.
Тогда
 .
.
Произведем вычисления:
 .
.
Работа расширения газа при постоянном давлении (p 1=const) выражается формулой A 1 =p 1×D V=p 1(V 2– V 1). Работа газа, нагреваемого при постоянном объеме, равна нулю, т.е. А2 =0. Следовательно, полная работа, совершенная газом:
А=А 1 +А 2 =А 1 =p 1(V 2– V 1).
Произведем вычисления:
A =2×105×(3-1) Дж = 4×105 Дж.
Согласно первому закону термодинамики, теплота Q, переданная газу, равна сумме изменения внутренней энергии DU и работы A: Q =D U + A. Следовательно,
 Q =32,5×105 Дж + 4×105 Дж =
Q =32,5×105 Дж + 4×105 Дж =
=36,5×105 Дж =3,65 МДж.
График процесса приведен на рисунке 11.
|
Пример 5. В цилиндре под поршнем находится водород массой m =0,02 кг при температуре T1 =300 К. Водород сначала расширился адиабатно, увеличив свой объем в n1 =5 раз, а затем был сжат изотермически, причем объем газа уменьшился в n2 =5 раз. Найти температуру в конце адиабатного расширения и работу, совершенную газом при этих процессах. Изобразить процесс графически.
| Дано: | Решение: |
| M =0,02 кг Т1 =300 К n1 =5 n2 =5 | Температуры и объемы газа, совершающего адиабатический процесс, связаны между собой соотношением
 , (1) , (1)
|
| T 2-? A 1-? A 2-? |
где g – показатель адиабаты,  ;
;
i – число степеней свободы молекулы.
Для водорода как двухатомного газа i =5. Следовательно,  . Так как
. Так как  , то
, то  , откуда
, откуда
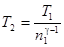 . (2)
. (2)
Работа А1 газа при адиабатическом расширении может быть определена по формуле:
 , (3)
, (3)
где СV – молярная теплоемкость газа при постоянном объеме;
М – молярная масса газа.
Работа А 2 при изотермическом процессе может быть выражена в виде:
 , или
, или  , (4)
, (4)
где  .
.
Подставляя числовые значения величин в выражения (2), (3) и (4), произведем вычисления, учитывая, что для водорода М =2×10-3 кг/моль.
 К.
К.
(50,4= x; или lg x =0,4lg5=0,2796, тогда x =1,91; 50,4=1,91)

 .
.

|
|
|
Пример 6. Температура нагревателя тепловой машины 500 К. Температура холодильника 400 К. Определить КПД тепловой машины, работающей по циклу Карно, и полную мощность машины, если нагреватель ежесекундно передает ей 1675 Дж теплоты.
| Дано: | Решение: |
| Tн =500 К Тх =400 К Qн =1675 Дж t =1 c | КПД машины, работающей по циклу Карно, определяется по формуле
 , (1) , (1)
|
| h-? N -? |
или  . (2)
. (2)
Полная мощность машины
 , (3)
, (3)
или  . (4)
. (4)
Подставляя числовые значения в выражения (1) и (4), получим:
 ; h=20%.
; h=20%.
 .
.
Ответ: h=20%; N =335 Вт.
Пример 7. Найти изменение энтропии при переходе 8 г кислорода от объема 10 л при температуре 80°С к объему 40 л при температуре 300оС.
| Дано: | Решение: |
| m =8 г=8×10-3 кг V1 =10 л=10-2 м3 T1 =353 К V2 =40 л=4×10-2 м3 T2 =573 К | Изменение энтропии:
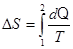 .
Согласно первому закону термодинамики
d Q = dU + dA .
Согласно первому закону термодинамики
d Q = dU + dA
|
где  – изменение внутренней энергии газа;
– изменение внутренней энергии газа;
dA = p × dV – работа газа при изменении объема.
Из уравнения Менделеева-Клапейрона  находим давление газа
находим давление газа  . Тогда
. Тогда  , а
, а  .
.
Следовательно 
 ,
,
или 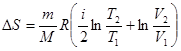 .
.
Произведем вычисления, учитывая, что для кислорода i =5; М =32×10-3 кг/моль.

Ответ: D S = 5,4 Дж/К.
К о н т р о л ь н а я р а б о т а № 1
| Вар. | Номера задач | |||||||||
101. Тело брошено вертикально вверх с начальной скоростью 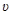 o=4м/с. Когда оно достигло верхней точки полета из того же начального пункта, с той же начальной скоростью
o=4м/с. Когда оно достигло верхней точки полета из того же начального пункта, с той же начальной скоростью 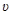 о вертикально вверх брошено второе тело. На каком расстоянии h от начального пункта встретятся тела? Сопротивление воздуха не учитывать.
о вертикально вверх брошено второе тело. На каком расстоянии h от начального пункта встретятся тела? Сопротивление воздуха не учитывать.






