Самопроизвольно идущий окислительно-восстановительный процесс в определенных условиях может создавать электрическую энергию. Процессы превращения химической энергии в электрическую можно использовать для создания химических источников тока (ХИТ), простейший из которых гальванический элемент.
Гальванический элемент состоит из двух электродов, погруженных в электролиты, которые замыкаются электролитическим ключом.
КЛАССИФИКАЦИЯ ЭЛЕКТРОДОВ
Металлический электрод - это металл, погруженный в раствор собственной соли, не является инертным, а участвует в электродной реакции. Cхематично такой электрод записывают в виде Ме|Ме n +, где вертикальная черта обозначает границу между металлом и раствором. Уравнение Нернста для металлических электродов имеет вид
 , (4)
, (4)
где  - концентрация ионов металла в растворе, моль/л.
- концентрация ионов металла в растворе, моль/л.
Окислительно-восстановительный (редокс-) электрод – это инертный металл (токоподвод), погруженный в электролит, содержащий одновременно окисленную и восстановленную формы потенциалопределяющих частиц. В качестве инертного металла чаще всего используют платину Pt. Схематично такой электрод можно записать в виде Pt│Me n +, Me m +. На поверхности инертного металла протекает окислительно-восстановительная реакция. Например, для окислительно-восстановительного электрода Pt│Sn4+, Sn2+ такими реакциями могут быть: Sn2+ - 2 ē → Sn4+; Sn4+ + 2 ē → Sn2+
Уравнение Нернста для редокс- систем включает концентрацию обоих катионов и имеет вид
 (5)
(5)
где [окисл], [восст] – концентрации окисленной и восстановленной форм потенциалопределяющих частиц в полуреакции.
Газовые электроды состоят из инертного металла, который находится в одновременном контакте с газом и раствором, содержащим ионы этого газа. Представителями газовых электродов являются водородный, кислородный, хлорный и другие электроды.
Водородный электрод состоит из платиновой пластинки, покрытой слоем мелкодисперсной платины ("платиновой черни") и погруженной в раствор кислоты, содержащий ионы водорода. Через раствор непрерывно пропускается поток водорода, водород адсорбируется на поверхности платины, и на границе электрод/раствор устанавливается равновесие:
H+(раствор) + ē ↔ ½ H2 (г).
При давлении водорода, равном 101,3 кПа (1 атм), активности (концентрации) ионов водорода 1 моль/л и Т =298К водородный электрод называется стандартным водородным электродом. Потенциал такого электрода принимается за ноль.
Уравнение Нернста для водородного электрода имеет вид
 , (6)
, (6)
где  - стандартный электродный потенциал,
- стандартный электродный потенциал,
 - концентрация ионов водорода в растворе, моль/л
- концентрация ионов водорода в растворе, моль/л
 -парциальное давление водорода над раствором, атм. равно 1 атм.
-парциальное давление водорода над раствором, атм. равно 1 атм.
Рассмотрим работу гальванического элемента на примере элемента Даниэля-Якоби. Он представляет собой два сосуда с 1М растворами CuSO4 и ZnSO4, в которые погружены соответственно медная и цинковая пластинки, соединенные проводом. Сосуды соединены между собой трубкой, которая называется солевым мостиком, заполненной раствором электролита (например, KCl). Солевой мостик является электролитическим ключом.
Электрод с меньшим значением потенциала заряжается отрицательно, является анодом. Электрод с большим значением потенциала заряжается положительно, является катодом. На аноде протекает процесс окисления
(отдача электронов), на катоде – процесс восстановления (присоединение электронов).
Гальванические элементы принято записывать в виде схем. Анод со знаком (-) записывают слева, катод со знаком (+) записывают справа. Например, схема медно-цинкового гальванического элемента Даниэля-Якоби может быть представлена таким образом:





 ē ē
ē ē
(-) Zn|ZnSO4||CuSO4|Cu (+) или (-) Zn|Zn2+||Cu2+|Cu (+)
Одна вертикальная черта на схеме обозначает границу между металлом и раствором электролита, две черты – границу между растворами (солевой мостик).
При замыкании цепи электроны по внешней цепи пойдут от анода к катоду – от цинка к меди. При этом на электродах протекают следующие реакции:
(-) Анод: Zn – 2 ē → Zn2+ реакция окисления
(+) Катод: Cu2+ + 2 ē →Cu реакция восстановления
Суммируя процессы на катоде и аноде, получаем уравнение окислительно-восстановительной реакции, за счет которой в гальваническом элементе возникает электрический ток:
Zn + Cu2+ = Zn2+ + Cu
Такое уравнение называется уравнением токообразующей реакции.
ЭДС гальванического элемента рассчитывают как разность потенциалов катода и анода: Е = Е к– Е а.
Если концентрация ионов в растворе составляет 1 моль/л, то ЭДС называется стандартной. Стандартная ЭДС медно-цинкового элемента при 

 -
- 
Пример 7. Рассчитайте ЭДС свинцово-цинкового гальванического элемента при Т = 298К, в котором [Zn2+]=0,1моль/л и [Pb2+]=0,01моль/л. Укажите знаки полюсов, напишите уравнения электродных процессов, составьте схему гальванического элемента. Укажите направление движения электронов при замыкании цепи.
Решение: ЭДС гальванического элемента рассчитывают как разность
равновесных потенциалов катода и анода: Е = Е к – Е а.
Поскольку концентрации потенциалопределяющих ионов отличаются от 1 моль/л, рассчитаем по уравнению Нернста (ур. 4) значения электродных потенциалов цинка и свинца:

 Электрод с меньшим значением потенциала является анодом (цинковый электрод). На нем протекает реакция окисления:
Электрод с меньшим значением потенциала является анодом (цинковый электрод). На нем протекает реакция окисления:
(-) А: Zn – 2 ē → Zn2+
Электрод с большим значением потенциала является катодом (свинцовый электрод), на нем протекает реакция восстановления:
(+) К: Pb2+ + 2 ē → Pb
Уравнение токообразующей реакции: Zn + Pb2+ → Zn2+ + Pb.
Схема гальванического элемента: (-) Zn│Zn2+(0,1M)║Pb2+(0,01M)│Pb (+).
Рассчитываем ЭДС гальванического элемента:
Е = Е к – Е а = 
При замыкании цепи, электроны во внешней цепи пойдут от отрицательно заряженного электрода к положительно заряженному электроду, то есть - от цинка к свинцу.
Пример 8. Для гальванического элемента
Pt│Cr3+ (0,1 моль/л), Cr2+(0,01 моль/л)║Н+(рН=2)│Н2, Pt
рассчитать ЭДС, написать уравнения электродных процессов, составить уравнение токообразующей реакции, указать знаки полюсов. Определить направление движения электронов во внешней цепи.
Решение: данный гальванический элемент составлен из окислительно-
восстановительного и водородного электродов.
Потенциал окислительно-восстановительного электрода рассчитываем по уравнению Нернста: 
Стандартный потенциал пары Сr3+/Cr2+  . Подставив данные условия задачи, рассчитаем потенциал окислительно-восстановительного электрода:
. Подставив данные условия задачи, рассчитаем потенциал окислительно-восстановительного электрода:
 .
.
Второй электрод данного гальванического элемента является водородным электродом. Потенциал его, согласно уравнению Нернста:
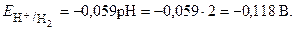
Определяем катод и анод. Поскольку окислительно-восстановительный электрод имеет меньший потенциал, то в гальваническом элементе он будет играть роль анода (отрицательный полюс), а водородный электрод – катода (положительный полюс). После замыкания цепи на первом электроде будет протекать анодный процесс окисления, на втором – катодный процесс восстановления:
 (-) А: Cr2+ - ē → Cr3+ 2
(-) А: Cr2+ - ē → Cr3+ 2
(+) К: 2 Н+ + 2 ē → Н2
Суммарная токообразующая реакция описывается уравнением
2 Cr2+ + 2 Н+ → 2 Cr3+ + Н2
Электроны при замыкании внешней цепи будут двигаться от отрицательного полюса к положительному: от хромового окислительно-восстановительного электрода к водородному.
ЭДС данного элемента 
Пример 9. Какие процессы протекают на электродах в концентрационном гальваническом элементе, имеющем цинковые электроды, если у одного из электродов концентрация ионов цинка Zn2+ равна 1 моль/л, а у другого –
0,0001 моль/л? Какова ЭДС этого элемента? Напишите схему данного ГЭ.
Решение: Концентрационный гальванический элемент состоит из одинаковых электродов, погруженных в растворы своих солей различной концентрации. Определим потенциалы обоих электродов. Так как концентрация ионов цинка
у первого электрода равна 1 моль/л, то потенциал его будет равен стандартному потенциалу цинкового электрода:  .
.
Потенциал второго электрода рассчитаем по уравнению Нернста:
 Первый электрод является катодом, на нем после замыкания цепи протекает реакция восстановления (+) К: Zn2+ + 2 ē →Zn
Первый электрод является катодом, на нем после замыкания цепи протекает реакция восстановления (+) К: Zn2+ + 2 ē →Zn
Второй электрод, имеющий меньший потенциал, будет анодом, на нем протекает реакция окисления: (-) А: Zn - 2 ē →Zn2+
Токообразующая реакция в гальваническом элементе будет иметь вид:
Zn + Zn2+→ Zn + Zn2+
Рассчитываем ЭДС элемента: Е = Е к - Е а = - 0,763 –(-0,881) = 0,122 В.
Данный гальванический элемент можно отобразить схемой:
(-) Zn│Zn2+(0,0001 моль/л)║Zn2+(1 моль/л)│Zn (+)
Задания
4. Написать катодный и анодный процессы, уравнение токообразующей реакции и вычислить ЭДС гальванического элемента. Указать полярность электродов.
1. Fe| Fe+2 (1моль/л) || Ag+(0,1моль/л) |Ag
2. Cr| Cr+3 (2 моль/л) || Cd+2 (1 моль/л)|Cd
3. Be| Be+2 (0,1моль/л) || Ni+2 (0,01моль/л) |Ni
4. Mn| Mn+2 (0,1 моль/л) || Sn+2 (0,01 моль/л)|Sn
5. Al| Al+3 (2 моль/л) || Cd+2 (0,1 моль/л)|Cd
6. Ni| Ni+2 (0,1 моль/л) || Cu+2 (0,01 моль/л)|Cu
7. Mg| Mg+2 (1 моль/л) || Zn+2 (0,01 моль/л)|Zn
8. Cd| Cd+2 (0,1 моль/л) || Pb+2 (0,01 моль/л)|Pb
9. Fe| Fe+2 (0,01 моль/л) || Fe+2 (1 моль/л)|Fe
10. Co|Co+2 (0,5 моль/л) || Ni+2 (0,5 моль/л)|Ni
11. Zn| Zn+2 (1 моль/л) || Cu+2 (0,01 моль/л)|Cu
12. Pt,H2|H+ (pH=4) || H+ (pH=2)|H2,Pt
13. Al|Al+3 (1 моль/л) ||Al+3 (2 моль/л)|Al
14. Mn|Mn+2 (1 моль/л) || Ni+2 (0,01 моль/л)|Ni
15. Ca|Ca+2 (0,1 моль/л) || Fe+2 (0,01 моль/л)|Fe
16. Pb|Pb+2 (1 моль/л) || Ag+ (0,1 моль/л)|Ag
17. Be|Be+2 (0,001 моль/л) || Fe+2 (0,001 моль/л)|Fe
18. Pt|Cr+3 (0,1 моль/л),Cr+2 (0,1 моль/л) || Fe+3 (0,1 моль/л), Fe+2 (0,1 моль/л)|Pt
19. Zn|Zn+2(1 моль/л) || Fe+2 (0,01 моль/л)|Fe
20. Al|Al+3 (2 моль/л) || Cu+2 (0,01 моль/л)|Cu
21. Be|Be+2 (1 моль/л) || Cd+2 (0,01 моль/л)|Cd
22. Mn|Mn+2 (0,01 моль/л) || Fe+2 (0,01 моль/л)|Fe
23. Fe|Fe+2 (1 моль/л) || Sn+2 (0,01 моль/л)|Sn
24. Mg|Mg+2 (0,1 моль/л) || Ni+2 (0,01 моль/л)|Ni
25. Ag|Ag+ (0,001 моль/л) || Ag+ (0,1 моль/л)|Ag
26. Fe| Fe+2 (0,005 моль/л) || Pb+2 (0,005 моль/л)|Pb
27. Ca|Ca+2 (1 моль/л) || Mg+2 (0,01 моль/л)|Mg
28. Mn|Mn+2 (0,01 моль/л) || Zn+2 (0,01 моль/л)|Zn
29. Pb|Pb+2 (0,1 моль/л) ||Cu+2 (0,01 моль/л)|Cu
30. Zn|Zn+2 (10-4 моль/л) || Sn+2 (10-2 моль/л)|Sn
31. Cd| Cd+2 (10-4 моль/л) || Cu+2 (10-2 моль/л)|Cu
32. Ni| Ni+2 (0,01 моль/л) || Ag+ (1 моль/л)|Ag
33. Mg| Mg+2 (0,001 моль/л) || Mg+2 (1 моль/л)|Mg
34. Ca| Ca+2 (1 моль/л)|| Cr+2 (0,01 моль/л)|Cr
35. Mn|Mn+2 (0,01 моль/л) || Pb+2 (0,01 моль/л)|Pb
36. Al| Al+3 (2 моль/л) || Cr+2 (0,01 моль/л)|Cr
37. Be| Be+2 (1 моль/л) || Sn+2 (0,01 моль/л)|Sn
38. Ni| Ni+2 (1 моль/л)|| Fe+3(2 моль/л)|Fe
39. Pt, H2|H+ (pH=4) || Ag+ (1 моль/л)|Ag
40. Mg| Mg+2 (10-2 моль/л) || Cu+2 (10-2 моль/л)|Cu
41. Cu| Cu+2 (0,01 моль/л) || Ag+ (0,1 моль/л)|Ag
42. Ca| Ca+2 (0,01 моль/л) || Be+2 (1 моль/л)|Be
43. Zn| Zn+2 (0,01 моль/л) || Ni+2 (1 моль/л)|Ni
44. Al| Al+3 (2 моль/л) || Fe+2 (0,01 моль/л)|Fe
45. Ca| Ca+2 (1 моль/л) || Al+3 (0,5 моль/л)|Al
46. Fe| Fe+3 (2 моль/л) || Cu+2 (0,01 моль/л)|Cu
47. Zn| Zn+2 (1 моль/л) || Pb+2 (0,01 моль/л)|Pb
48. Sn| Sn+2 (0,01 моль/л) || Ag+(0,1 моль/л)|Ag
49. Zn| Zn+2 (10-2 моль/л) || H+(pH=2)|H2,Pt
50. Pt| Sn+4 (0,1 моль/л),Sn+2 (0,1 моль/л) || Hg+2 (1 моль/л)|Hg
51. Al| Al+3 (2 моль/л) || Cd+2 (0,01 моль/л)|Cd
52. Pt|Cr+3(10-2 моль/л),Cr+2(0,1 моль/л) || Sn+4 (10-3 моль/л),Sn+2(0,1 моль/л)|Pt
53. Ni| Ni+2 (0,01 моль/л) || Pb+2 (0,01 моль/л)|Pb
54. Mg| Mg+2 (10-4 моль/л) || H+(pH=2)|H2,Pt
55. Cd| Cd+2 (10-2 моль/л) || Cd+2 (1 моль/л)|Cd
56. Be| Be+2 (10-4 моль/л) || Zn+2 (10-2 моль/л)|Zn
57. Mn| Mn+2 (1 моль/л) || Cu+2 (0,1 моль/л)|Cu
58. Ca| Ca+2 (0,01 моль/л) || Pb+2 (0,01 моль/л)|Pb
59. Sn| Sn+2 (0,01 моль/л) || Cu+2 (1 моль/л)|Cu
60. Cd| Cd+2 (10-1 моль/л) || Sn+2 (10-1 моль/л)|Sn
61.Pt|Fe+3(10-2 моль/л),Fe+2(0,1 моль/л) || Sn+4(10-2 моль/л),Sn+2(0,1 моль/л)|Pt
62.Pt|Co+3(10-2 моль/л), Co+2 (0,1 моль/л) ||Sn+4 (0,1 моль/л),Sn+2 (10-2 моль/л)|Pt
63. Pt|Fe+3(0,1 моль/л), Fe+2(10-2 моль/л) ||Au+ (10-2 моль/л), Au+3 (0,1 моль/л)|Pt






