При составлении уравнений ОВР нужно учесть, что число электронов, отданных восстановителем, равно числу электронов, принятых окислителем.
В химии электрон обозначается 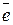
 его условный заряд принят за «-1»
его условный заряд принят за «-1»  Для подбора стехиометрических коэффициентов можно использовать несколько методов. К наиболее распространенным относятся метод электронного баланса и метод электронно-ионных уравнений (метод полуреакций).
Для подбора стехиометрических коэффициентов можно использовать несколько методов. К наиболее распространенным относятся метод электронного баланса и метод электронно-ионных уравнений (метод полуреакций).
Метод электронного баланса является наиболее универсальным методом и применим для любых окислительно-восстановительных процессов, протекающих в любых системах (растворы, расплавы, газы). В основе метода лежит принцип сравнения степеней окисления атомов в исходных веществах и в продуктах реакции с последующим составлением схемы электронного баланса.
Пример 2. Рассмотрим метод электронного баланса для уравнивания ОВ-реакции:
 +
+  +
+ 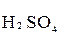 →
→  +
+  +
+  +
+ 
Для расстановки коэффициентов выполняем следующие действия.
1. Определяем элементы, атомы которых изменяют степень окисления:
 +
+  +
+ 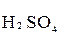 →
→  +
+  +
+  +
+ 
2. Находим окислитель и восстановитель в данной ОВР, составляем схему перехода электронов от восстановителя к окислителю и пишем отдельно электронные уравнения процессов окисления и восстановления с учетом того, что количество атомов, входящих в соединение, должно сохраняться. Например, в  имеется два атома Cr, следовательно, в уравнении они должны присутствовать:
имеется два атома Cr, следовательно, в уравнении они должны присутствовать:
+6 ē


 -2 ē
-2 ē
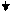


 +
+  +
+ 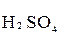 →
→  +
+  +
+  +
+ 
окислитель восстановитель
2Cr+6 + 6 ē = 2Cr+3 (а) - восстановление
S-2 - 2 ē  = S0 (б) – окисление
= S0 (б) – окисление
3. Уравниваем число электронов в процессе окисления и восстановления (составляем электронный баланс). В приведенной схеме необходимо уравнение (б) умножить на 3, тогда будет принято и отдано по 6 электронов. После умножения уравнения складываются как обычные алгебраические:

 2Cr+6 + 6 ē = 2Cr+3 1
2Cr+6 + 6 ē = 2Cr+3 1
+ S-2 - 2 ē  = S0 3
= S0 3
 |
2Cr+6 +3S-2 = 2Cr+3 + 3 S0
4. Полученные коэффициенты называют основными. Они переносятся в молекулярную схему реакции и ставятся перед соответствующими веществами. Так как в молекулах K2Cr2O7 и Cr2(SO4)3 содержится по два атома хрома, двойки перед этими веществами опускаются.
K2Cr2O7 + 3H2S + H2SO4 = Cr2(SO4)3 + 3S + K2SO4 + H2O
5. Окончательно уравниваем число атомов каждого элемента в обеих частях молекулярного уравнения. Продукты реакции (Cr2(SO4)3, K2SO4), имеющие коэффициенты по единице, содержат 4 моль сульфат-ионов (SO42-), которые содержатся в серной кислоте, следовательно, перед ней ставится коэффициент 4. Чтобы количество атомов водорода было одинаково в левой и правой частях уравнения, перед водой ставится коэффициент 7:
K2Cr2O7 + 3H2S + 4H2SO4 = Cr2(SO4)3 + 3S + K2SO4 + 7H2O
Проверка количества остальных атомов показывает, что все коэффициенты подобраны.
Метод электронно-ионных уравнений (метод полуреакций). Этот метод основан на составлении уравнений процессов окисления и восстановления с помощью ионов и молекул, реально существующих в растворе. Степени окисления атомов не используют, а учитывают заряды ионов и характер среды (рН), в которой протекает ОВ-реакция. В качестве частиц среды в водных растворах могут принимать участие следующие частицы: Н+, ОН- и Н2О.
Для написания уравнения в ионно-молекулярной форме следует знать:
1. Сильные кислоты (например, HCl, H2SO4, HNO3) распадаются на ионы H+ и кислотный остаток, например, H2SO4 ®2H+ +SO42-
Слабые кислоты, для которых константа диссоциации К д<10-3 (например, H2S, HCN), практически не диссоциируют на ионы и записываются в молекулярном виде.
2. Сильные основания (например, LiOH, NaOH, KOH) распадаются на катион металла и гидроксид-ион OH-, например, КОН ®К+ +OH-
Слабые основания, для которых К д<10-3 (например, NH4OH), практически не диссоциируют на ионы и записываются в молекулярном виде.
3. Соли распадаются на катионы металла и кислотный остаток. Например, KBr ®K+ +Br-1:
K BrО3 ® K+ + BrО3-1
K2Cr2O7® 2 K+ + Cr2O72-
4. Оксиды (например, MnO2, FeO, Fe2O3, CO2, SO2, NO) не распадаются на ионы.
5. Вода Н2О (К д=1,8.10-16), пероксид водорода Н2О2 (К д=1.10-25) как слабые электролиты, не распадаются на ионы.
Схема метода ионно-электронных уравнений:
1. Написать уравнение в ионно-молекулярной форме.
2. Определить кислотно-щелочность среды.
3. Определить частицы, изменившие свой заряд или состав, и записать реакции их превращения.
4. Составить материальный баланс для этих превращений, то есть количество атомов каждого из присутствующих элементов в левой и правой частях уравнения должно быть одинаково.
Если исходные вещества содержат большее число атомов кислорода, чем полученные продукты, то в кислой среде каждый атом кислорода можно связать двумя ионами водорода в воду, а в нейтральной и щелочной средах молекулой воды в гидроксид-ионы.
Если исходные вещества не содержат кислорода или содержат меньшее
число атомов кислорода, чем полученные продукты, то недостающее число атомов кислорода можно восполнить в нейтральной и кислой средах за счет молекул воды, а в щелочной – за счет двух ионов ОН-.
5. Уравнять полученные реакции по зарядам с участием электронов.
6. Составить электронный баланс между полуреакциями, учитывая, что количество принятых электронов должно равняться количеству отданных. Далее просуммировать полуреакции: сложить отдельно левые части и отдельно правые части уравнений. Если в суммарном уравнении имеются одинаковые частицы в левой и правой частях уравнения, то их сократить.
7. Полученные коэффициенты перенести в молекулярное уравнение и проверить материальный баланс.
Пример 3. Рассмотрим метод электронно-ионных уравнений для уравнивания ОВ-реакций между KMnO4 и KNO2 в кислой, нейтральной и щелочной средах.






