KMnO4 + KNO2 + H2SO4 ®MnSO4 + KNO3 + K2SO4 + H2O
1. Записываем это уравнение в ионно-молекулярной форме. Для этого все сильные электролиты представляем в виде ионов, а слабый электролит H2O оставляем в виде молекул:
K++MnO4- +Na++NO2-+2H+ +SO42- ®Na++NO3-+ Mn2++SO42- +2K++SO42-+H2O
2. В уравнении присутствуют ионы Н+, следовательно, реакция протекает в кислой среде.
3. Определяем частицы, изменившие свой заряд или состав:
MnO4-® Mn2+ и NO2-® NO3-
4. На основании этих превращений составляем материальный баланс с участием частиц среды. Ион MnO4- потерял 4 моль атомов кислорода, которые в кислой среде связываются 8 моль ионами водорода и превращаются в воду. Ион NO2- с участием воды приобрел 1 моль атомов кислорода:
MnO4- + 8H+ ® Mn2+ + 4H2O
NO2- + H2О ®NO3- + 2Н+
5. Полученные полуреакции необходимо уравнять по зарядам. В первом уравнении суммарный заряд слева равен (+7), а справа – (+2), значит, перманганат-ион присоединил 5 электронов и восстановился. Во втором уравнении слева (-1), а справа – (+1), следовательно, ион NO2- потерял 2 электрона и окислился:
MnO4- + 8H++ 5 ē ® Mn2+ + 4H2O
NO2- + H2О –2 ē ®NO3- + 2Н+
6. Для соблюдения электронного баланса первое уравнение необходимо умножить на 2, второе уравнение умножить на 5, после чего просуммировать уравнения:
 MnO4- + 8H++ 5 ē ® Mn2+ + 4H2O 2
MnO4- + 8H++ 5 ē ® Mn2+ + 4H2O 2
+
NO2- + H2О – 2 ē ®NO3- + 2Н+ 5
 |
2MnO4- + 16H+ +5NO2- + 5H2О ®2Mn2+ + 8H2O + 5NO3- + 10Н+
В левой и правой частях уравнения имеются одинаковые частицы: H+ и H2O. После их сокращения получаем сокращенное ионно-молекулярное уравнение:
2MnO4- + 6H+ +5NO2- + ®2Mn2+ + 3H2O + 5NO3-.
7. Далее переносим коэффициенты в исходное уравнение:
2KMnO4 + 5 KNO2 +3H2SO4 =2MnSO4 + 5 KNO3 + K2SO4 + 3 H2O
и проверяем материальный баланс.
2) в нейтральной среде реакция протекает по уравнению
KMnO4 + KNO2 + H2O ®MnO2 + KNO3 + KOH
1. Записываем это уравнение в ионно-молекулярной форме. Сильные электролиты записываем в виде ионов, а слабый электролит H2O и малорастворимый MnO2 в виде молекул:
K+ + MnO4- + K+ +NO2- +H2O ®MnO2 + K++ NO3- + K+ + OH-
2. В уравнении присутствует Н2О, следовательно, реакция протекает в нейтральной среде.
3. Определяем частицы, изменившие свой заряд и состав:
MnO4- ® MnO2 и NO2- → NO3-
4. На основании этих превращений составляем материальный баланс с участием частиц среды. Ион MnO4- потерял 2 моль атомов кислорода, которые в нейтральной среде связываются 2 моль H2О и образуют 4 моль OН-. Ион NO2- с участием воды приобрел 1 моль атомов кислорода:
MnO4- + 2H2О ® MnО2 + 4OН-
NO2- + H2О ®NO3- + 2 Н+
5. Полученные полуреакции необходимо уравнять по зарядам. В первом уравнении слева суммарный заряд равен (-1), а справа – (-4), значит, перманганат-ион присоединил 3 электрона и восстановился. Во втором уравнении слева суммарный заряд (-1), а справа – (+1), следовательно, ион NO2- потерял 2 электрона и окислился:
MnO4- + 2H2О+ 3 ē ® MnО2 + 4OН-
NO2- + H2О – 2 ē ®NO3- + 2 Н+
6. Для соблюдения электронного баланса первое уравнение необходимо умножить на 2, второе уравнение умножить на 3, после чего просуммировать уравнения:

 + MnO4- + 2H2О+ 3 ē ® MnО2 + 4OН- 2
+ MnO4- + 2H2О+ 3 ē ® MnО2 + 4OН- 2
NO2- + H2О –2 ē ®NO3- + 2 Н+ 3
 |
 2MnO4- + 4H2О +3NO2- + 3 H2О ®2MnO2+8ОH- + 6H++3NO3-
2MnO4- + 4H2О +3NO2- + 3 H2О ®2MnO2+8ОH- + 6H++3NO3-
6 H2O +2 OН-
В правой части уравнения имеются 8ОH- и 6H+, которые в сумме образуют 6 моль H2O и 2 моль ионов OН-. В левой части уравнения имеется 7 моль H2О. После сокращения H2О в левой и правой частях уравнения получаем сокращенное ионно-молекулярное уравнение:
2MnO4- +3NO2- + H2О ® 2MnO2+2ОH- +3NO3-
7. Далее переносим коэффициенты в исходное уравнение:
2KMnO4 + 3 KNO2 +H2O =2MnO2 + 3 KNO3 + 2KOH
и проверяем материальный баланс.
3) в щелочной среде реакция протекает по уравнению
KMnO4 + KNO2 + KOH ®K2MnO4 + KNO3 + H2O
1. Записываем это уравнение в ионно-молекулярной форме. Для этого все сильные электролиты представляем в виде ионов, а слабый электролит H2O оставляем в виде молекул:
K+ +MnO4- + K++NO2- +K++OH- ®2K++ MnO42- +K++NO3- + H2O
2. В уравнении присутствуют ионы OH-, следовательно, реакция протекает в щелочной среде.
3. Определяем частицы, изменившие свой заряд или состав:
MnO4- ® MnO42- и NO2- → NO3-
4. На основании этих превращений составляем материальный баланс с участием частиц среды. Ион MnO4- сохранил свой состав, но изменил заряд. Ион NO2- в щелочной среде с участием 2 моль OH- приобрел 1 моль атомов кислорода:
MnO4- ® MnO42-
NO2- + 2 OH-→ NO3- + Н2O
5. Полученные полуреакции необходимо уравнять по зарядам. В первом уравнении слева суммарный заряд равен (-1), а справа – (-2), значит, перманганат-ион MnO4-присоединил 1 электрон и восстановился. Во втором уравнении слева (-3), а справа – (-1), следовательно, ион NO2- потерял 2 электрона и окислился:
MnO4- + ē ® MnO42-
NO2- + 2 OH- + 2 ē → NO3- + Н2O
6. Для соблюдения электронного баланса первое уравнение необходимо умножить на 2, после чего просуммировать уравнения:

 + MnO4- + ē ® MnO42- 2
+ MnO4- + ē ® MnO42- 2
NO2- + 2 OH- + 2 ē → NO3- + Н2O
 2MnO4- + NO2- + 2 OH- ® 2MnO42- + NO3- + Н2O
2MnO4- + NO2- + 2 OH- ® 2MnO42- + NO3- + Н2O
7. Далее переносим коэффициенты в исходное уравнение:
2KMnO4 + KNO2 +2KOH =2K2MnO4 + KNO3 + H2O
и проверяем материальный баланс.
Пример 4. Рассмотрим метод электронно-ионных уравнений для реакции, в которой окислитель является одновременно и средой на примере:
I2 + HNO3® HIO3 +NO2 +H2O
В этой реакции азотная кислота HNO3 одновременно содержит окислитель ион NO3- и создает кислую среду (наличие ионов Н+).
1. Представим молекулярное уравнение в ионно-молекулярном виде. Простое вещество I2, газ NO2, и слабый электролит H2O оставляем в виде молекул:
I2 + H+ + NO3-® IO3- +NO2 +H2O
2. Далее составим полуреакции окисления и восстановления с учетом того, что реакция протекает в кислой среде, и для соблюдения электронного баланса умножим первое уравнение на 10, а затем полуреакции просуммируем:
 NO3- + 2H+ + ē ®NO2 +H2O 10
NO3- + 2H+ + ē ®NO2 +H2O 10
+ I2 + 6H2O - 10 ē ® 2IO3- + 12H+

10NO3- + 20 H+ + I2 + 6H2O®10NO2 +10 H2O + 2 IO3- + 12H+
После сокращения ионов H+ в левой и правой частях уравнения получим суммарное ионно-молекулярное уравнение:
10NO3- + 8 H+ + I2 ®10NO2 +4 H2O + 2 IO3-
3. Затем полученные коэффициенты перенесем в молекулярное уравнение реакции. Учитывая, что ионы NO3- и H+ входят в состав одного и того же соединения, а количество их разное, перед HNO3 ставится максимальный коэффициент, так как часть азотной кислоты расходуется на создание кислой среды. Таким образом, полное уравнение:
I2 + 10HNO3®2HIO3 +10NO2 +4H2O
Пример 5. Окислительно- восстановительная реакция выражается ионным уравнением: Cr2O72– + I– + H+ → Cr3+ + I2 + H2O
Составьте полное молекулярнoe уравнениe.
Решение. Полное молекулярное уравнение означает, что в уравнение входят нейтральные вещества и имеется материальный баланс по атомам всех
 элементов. Чтобы создать баланс, необходимо расставить коэффициенты в уравнении. Для определения коэффициентов используем метод электронно-ионных уравнений:
элементов. Чтобы создать баланс, необходимо расставить коэффициенты в уравнении. Для определения коэффициентов используем метод электронно-ионных уравнений:
 + Cr2O72–+ 14 H+ +6 ē → 2 Cr3+ + 7H2O
+ Cr2O72–+ 14 H+ +6 ē → 2 Cr3+ + 7H2O
 2I– - 2 ē
2I– - 2 ē 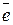 → I2 3
→ I2 3
Cr2O72– +6 I– + 14 H+ →2 Cr3+ + 3I2 + 7H2O
Для написания молекулярного уравнения к имеющимся в реакции ионам подбираем противоположно заряженные ионы таким образом, чтобы нейтральные вещества являлись сильными электролитами. К анионам Cr2O72– и I– добавляем такие катионы, c которыми анионы образуют хорошо растворимые соли (например, К+ и Na+); а к катионам Н+ добавляем такой кислотный остаток, который приводит к образованию сильной кислоты (например, SO4 2-). Таким образом, получаем уравнение:
К2Cr2O72– +6NaI + 7H2SO4 → Cr2(SO4) + 3I2 + 3H2O
Введение в левую часть уравнения ионов К+ и Na+ приводит к образованию соответствующих солей в правой части уравнения:
К2Cr2O72– +6NaI + 7H2SO4 = Cr2(SO4)3 + 3I2 + 7H2O + K2SO4 + 3Na2SO4




