ХИМИЯ
Методические указания, контрольные задания по курсу общей химии для студентов нехимических специальностей заочной формы обучения
Часть 2
Нижний Новгород 2013
Составители: А.Д. Самсонова, О.Н. Ковалева, Т.В Сазонтьева, Г.А. Паничева
УДК 54 (07)
Химия: методические указания, контрольные задания по курсу общей химии для студентов нехимических специальностей заочной формы обучения/ НГТУ им. Р.Е. Алексеева сост.: А.Д. Самсонова, О.Н. Ковалева, Т.В Сазонтьева, Г.А. Паничева Н.Новгород, 2013. 54 с.
Предложены теоретическая часть, примеры решения типовых задач и задания по темам: «Окислительно-восстановительные реакции», «Электрохимические процессы», «Коррозия»
Научный редактор Наумов В.И.
Редактор Э. Б. Абросимова
Подп. к печ.11.04. 2013 Формат 60х84 1/16. Бумага газетная.
Печать офсетная. Печ. л. 3,375. Уч.-изд. л. 2,6.
Тираж 1500 экз. Заказ

Нижегородский государственный технический
университет им. Р.Е. Алексеева
Типография НГТУ. 603950, Н.Новгород, ул. Минина, 24.
© Нижегородский государственный технический университет, им. Р.Е. Алексеева, 2013
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Оксилительно-восстановительные реакции (ОВР) – это такие реакции, в которых происходит передача электронов от одних частиц (атомов, молекул, ионов) к другим, в результате чего степень окисления атомов, входящих в состав этих частиц, изменяется.
СТЕПЕНЬ ОКИСЛЕНИЯ
Степень окисления элемента – это условный заряд его атома в молекуле, если считать, что молекула состоит из ионов. Она может быть положительной, отрицательной и нулевой.
Для нахождения степеней окисления используют следующие правила:
1. Степени окисления элементов в простых веществах равны «0» (например,  ,
, 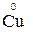 ,
,  ,
,  );
);
2. Степень окисления щелочных металлов всегда равна «+1», а щелочноземельных «+2» (например,  ,
,  ,,
,,  );
);
3. Степень окисления фтора равна «-1» ( );
);
4. Водород проявляет во всех соединениях степень окисления «+1», за исключением гидридов щелочных и щелочноземельных металлов, в которых степень окисления водорода равна «–1» (например, ( ,
,  );
);
5. Степень окисления кислорода в соединениях равна –2, кроме пероксидов, в которых степень окисления равна «-1» (например,  ,
,  ).
).
6. Алгебраическая сумма степеней окисления всех атомов в нейтральной молекуле равна нулю, а в ионе – заряду иона.
Пример 1. Определить степень окисления серы в молекуле H2SO4.
Решение. Атом водорода имеет степень окисления +1, а атом кислорода - 2.
Для определения степени окисления серы в молекуле  составляем уравнение 2 (+1) + x + 4(-2) = 0, откуда х = +6.
составляем уравнение 2 (+1) + x + 4(-2) = 0, откуда х = +6.
Именно это число и является степенью окисления серы 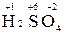 .
.
Окислительно-восстановительная реакция – это единый процесс, состоящий из двух полуреакций: полуреакции окисления и полуреакции восстановления, которые идут одновременно.
Окисление – это процесс отдачи электронов атомом, молекулой или ионом.
Восстановление – это процесс присоединения электронов атомом, молекулой или ионом.
Частица, отдающая свои электроны, в ходе реакции окислятся. Ее принято называть ВОССТАНОВИТЕЛЕМ (обозначим ее как ВОС):
ВОС - nē → продукт окисления (окисленная форма).
Частица, которая эти электроны присоединяет, в ходе реакции восстанавливается. Ее принято называть ОКИСЛИТЕЛЕМ (обозначим ее как ОК):
ОК + nē → продукт восстановления (восстановленная форма).
Например, в реакции  +
+  →
→  +
+ 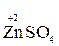
 - 2 ē →
- 2 ē →  (полуреакция окисления)
(полуреакция окисления)
Восстановитель окисленная форма
 + 2 ē
+ 2 ē  →
→  (полуреакция восстановления)
(полуреакция восстановления)
Окислитель восстановленная форма
Соединения, имеющие в своем составе атомы, в высшей положительной степени окисления могут проявлять только окислительные свойства. Соединения, имеющие в своем составе атомы, в низшей отрицательной степени окисления могут проявлять только восстановительные свойства. Соединения, имеющие в своем составе атомы, в промежуточной степени окисления могут проявлять как окислительные, так и восстановительные свойства.
Например, азот может иметь следующие степени окисления: -3, -2, -1, +3, +5. В соединении KNO2 азот имеет промежуточную степень окисления +3, следовательно, нитрит-ион NO2- может проявлять как окислительные, так и восстановительные свойства. С достаточно сильным восстановителем он может реагировать как окислитель:
2 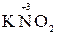 + 2
+ 2 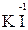 + 4 HCl→
+ 4 HCl→  + 2
+ 2  + 4KCl + 2H2O,
+ 4KCl + 2H2O,
а с достаточно сильным окислителем – как восстановитель:
5 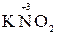 +2
+2  + 3H2SO4 → 2
+ 3H2SO4 → 2  + 5
+ 5  + K2SO4 + 3H2O
+ K2SO4 + 3H2O
СОСТАВЛЕНИЕ УРАВНЕНИЙ






