При практическом измерении температуры плавления руководствуются следующим определением:
Под температурой плавления вещества подразумевается интервал температур между началом плавления – появлением первой капли жидкости и концом плавления – полным переходом вещества в жидкое состояние (Государственная Фармакопея XI, т.I. М., "Медицина", 1987, с.16).
Чистые вещества плавятся при постоянной температуре, значение которой определяется природой вещества. В присутствии примесей образцы плавятся в интервале температур. Измеряя температуру плавления можно идентифицировать вещество, установить степень его чистоты. По разнице в температурах плавления растворителя и раствора вещества в данном растворителе можно определить, например, молярную массу растворенного вещества. Измерение температуры плавления можно использовать и для других целей.
При измерении температуры плавления смесей (в том числе растворов), плавящихся в интервале температур, определяют температуру конца плавления (исчезновения последнего кристалла), при измерении температуры замерзания смесей (растворов) определяют температуру начала замерзания (появления первого кристалла).
Если температуру плавления измерять капиллярным методом, в котором исследуемое вещество находится в стеклянном капилляре, а ртутный резервуар термометра опущен в масляную баню, в момент полного плавления вещества в капилляре температуры бани и внутри капилляра могут не совпадать. Для точного определения температуры плавления в этом случае измеряют температуру исчезновения последнего кристалла при нагревании и температуру появления первого кристалла при охлаждении. Если эти температуры не совпадают (и разница не превышает 20С), за температуру плавления принимают их среднее арифметическое значение.
Устройство установки для определения температура плавления капиллярным методом и последовательность работы с ней.
Установка состоит из масляной (парафиновой) бани; термометра; стеклянного капилляра, заполненного исследуемым веществом; плитки; подставки; штатива.

Исследуемое вещество помещают в капилляр диаметром 1 мм и длиной 6 см, запаянный с одного конца. Заполнение капилляра веществом проводят так: небольшое количество хорошо измельченного вещества помещают на чистую поверхность и, прикасаясь открытым концом капилляра к веществу, вводят его в капилляр небольшими порциями. Затем перемещают вещество к запаянному концу, постукивая этим концом по твердой поверхности, либо бросая капилляр запаянным концом вниз в вертикально расположенную стеклянную трубку высотой не менее 50 см.
Операцию повторяют насколько раз, пока высота слоя вещества не будет равна 3 мм. Необходимо, чтобы столбик вещества в капилляре был плотным без видимых разрывов.
Подготовленный таким образом капилляр с помощью резинового кольца укрепляют на термометре так, чтобы столбик вещества находился на уровне середины ртутного резервуара термометра, а резиновое кольцо при погружении термометра с капилляром в масляную баню не касалось масла. Термометр с капилляром закрепляют в лапке штатива и опускают в предварительно нагретую баню. При этом термометр не должен касаться дна и стенок бани, а уровень жидкости в бане должен быть выше резервуара термометра примерно на 5 мм.
Масляную баню медленно нагревают со скоростью примерно 1,50 С в минуту. Отмечают температуру (t1), когда в капилляре исчезает последний кристаллик исследуемого вещества. Затем отключают плитку, заменяют ее на подставку, следя за тем, чтобы капилляр, закрепленный на термометре, не извлекался из масляной бани. Отмечают температуру (t2), когда в капилляре появится первый кристалл. Если разница в температурах t1 и t2 превышает 20С, опыт следует повторить, уменьшая скорость нагревания и охлаждения. Температуру плавления рассчитывают по формуле:

В о п р о с ы д л я с а м о к о н т р о л я п о т е м е:"Определение температуры плавления капиллярным методом".
1. Физико-химическое определение понятия "температура плавления" (замерзания).
2. Определение понятия "температура плавления" по Фармакопее.
3. Какую температуру принимают за температуру плавления для смеси веществ, которая может плавиться в широком интервале температур?
4. Какие (какая) величины измеряются непосредственно в опыте при определении температуры плавления капиллярным методом?
5. Почему при измерении температуры плавления капиллярным методом в опыте определяют две величины: температуру исчезновения последнего кристалла при нагревании и температуру появления первого кристалла при охлаждении?
6. Какая из двух температур: температура исчезновения последнего кристалла при нагревании t1 или температура появления первого кристалла при охлаждении t2 может быть выше? Почему?
7. Если температура исчезновения последнего кристалла при нагревании t1 и температура появления первого кристалла при охлаждении t2 не одинаковы, то какая разница в значениях этих температур допустима?
8. Если при измерении температуры плавления капиллярным методом, t1 и t2 отличаются между собой более чем на 2 (4) градуса, как добиться допустимой разницы температур?
9. Если в капилляре последний кристалл при нагревании исчезает при температуре t1, а первый кристалл при охлаждении появляется при температуре t2 (t1 = t2), то как по этим двум температурам следует определить tпл?
10. Состав установки для определения температуры плавления капиллярным методом. 11. Размеры капилляра.
12. Заполнение капилляра веществом. Требования к заполнению.
13. Почему при заполнении капилляра веществом следует следить за тем, чтобы столбик вещества был плотным без видимых разрывов? Как это достигается?
14. Если при расплавлении вещества в капилляре появился пузырек воздуха, как от него освободиться?
15. Требования к закреплению капилляра на термометре.
16. Требования к закреплению термометра с капилляром при погружении их в масляную баню.
17. Основные этапы определения температуры плавления капиллярным методом.
18. С какой скоростью следует нагревать масляную баню?
19. Какое требование следует соблюдать при перенесении масляной бани с термометром и капилляром с плитки на подставку?
20. Какое вещество используют в качестве растворителя в методе Раста?
21. Почему в качестве растворителя в методе Раста рекомендуют использовать камфору?
22. Какое преимущество приобретает криометрический метод при использовании камфоры как растворителя?
23. Назовите ограничения метода Раста.
24. Назовите недостаток метода Раста.
25. Практическое значение измерения температуры плавления.
З А Н Я Т И Е № 17
ЗАЧЕТНОЕ ЗАНЯТИЕ
“Теория растворов есть первый пример
и образец для основания истинной
физической химии”.
М.В. Ломоносов
Т Е М А: «КОЛЛИГАТИВЫЕ СВОЙСТВА РАЗБАВЛЕННЫХ РАСТВОРОВ ЭЛЕКТРОЛИТОВ. ТЕОРИИ ОБРАЗОВАНИЯ РАСТВОРОВ ЭЛЕКТРОЛИТОВ»
I. МОТИВАЦИЯ ЦЕЛИ: Особенности большинства технологических процессов определяются свойствами водных растворов электролитов. При этом не следует игнорировать и неводные растворы, хотя их применяют значительно реже.
II. ЦЕЛЬ САМОПОДГОТОВКИ: составить представление о растворах электролитов, усвоить основные закономерности и понятия, знать особенности применения электролитов.
III. ИСХОДНЫЙ УРОВЕНЬ ЗНАНИЙ: понятия о составе растворов, механизме их образования, основы теории электролитической диссоциации.
IV. ПЛАН ИЗУЧЕНИЯ МАТЕРИАЛА ТЕМЫ:
1. Коллигативные свойства растворов электролитов.
2. Закон Рауля, следствия закона Рауля и закон Вант-Гоффа для разбавленных растворов нелетучих электролитов.
3. Изотонический коэффициент – определение понятию. Уравнение, связывающее изотонический коэффициент и степень диссоциации слабого электролита. Осмотический коэффициент.
4. Осмотическая концентрация (осмомолярность или осмомоляльность) и ее определение по величине понижения температуры замерзания растворов электролитов.
5. Свойства разбавленных растворов электролитов: понижение температуры плавления (замерзания), повышение температуры кипения, осмос – основа криометрического (криоскопического), эбулиоскопического и осмометрического методов исследования.
6. Криометрическое определение:
а) молярной массы растворенного вещества;
б) изотонического коэффициента, степени и константы диссоциации растворенного вещества, осмотического коэффициента;
в) осмотической концентрации и осмотического давления.
7. Разновидности криометрического метода анализа: метод Бекмана и метод Раста.
8. Теория электролитической диссоциации Аррениуса.
9. Закон разбавления Оствальда.
10. Теории Бренстеда-Лоури, Измайлова, Льюиса.
11. Теория Дебая-Хюккеля.
12. Современные представления о растворах электролитов.
V. Л И Т Е Р А Т У Р А:
1. Евстратова К. И., Купина Н. А., Малахова Е.Е. Физическая и коллоидная химия М., 1990, с. 74-82, 120-121.
2. Киреев В. А. Краткий курс физической химии М. 1978, с.374-391.
3. Стромберг А. Г., Семченко Д.П., Физическая химия М., 1999, с. 181-202.
4. Голиков г.А. Руководство по физической химии М., 1988, с.-201-214.
5. Лекционный материал.
VI. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ:
1. В чем заключается главное отличие коллигативных свойств электролитов от неэлектролитов?
2. Как изменяется давление насыщенного пара над раствором при диссоциации молекул растворенного вещества?
3. Как изменяется давление насыщенного пара над раствором при ассоциации молекул растворенного вещества?
4. Дайте определение понятию "степень диссоциации".
5. Что такое изотонический коэффициет? Запишите уравнение для расчета изотонического коэффициента по результатам криометрии.
6. Запишите уравнение, связывающее степень диссоциации и изотонический коэффициент.
7. Приведите уравнения, отражающие коллигативные свойства электролитов.
8. Приведите уравнения для расчета молярной массы растворенного вещества электролита по данным криометрии или эбулиометрии.
9. Какие два этапа следует выделить в расчетах молярной массы электролита по величинам 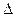 tзам и
tзам и 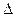 tкип, определенным в эксперименте.
tкип, определенным в эксперименте.
10. При определении степени диссоциации слабого электролита криометрически по данным эксперимента определяют понижение (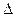 t) температуры замерзания раствора электролита заданного количественного состава по сравнению с температурой замерзания растворителя. Назовите два этапа в расчетах значения степени диссоциации по величине
t) температуры замерзания раствора электролита заданного количественного состава по сравнению с температурой замерзания растворителя. Назовите два этапа в расчетах значения степени диссоциации по величине 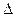 t и приведите соответствующие уравнения.
t и приведите соответствующие уравнения.
11. Приведите уравнения для расчета осмотического давления в разбавленных растворах электролитов, молярная концентрация которых с (закон Вант-Гоффа).
12. Имеются одномолярные растворы СаСl2 и NaCl. Какое из перечисленных для них условий выполняется: p1 = p2, p1 > p2, p1 < p2 и почему?
13. Приведите уравнение для расчета осмомоляльности раствора электролита по величине понижения (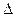 t) температуры замерзания раствора по сравнению с температурой замерзания растворителя.
t) температуры замерзания раствора по сравнению с температурой замерзания растворителя.
14. Какие два этапа следует выделить при определении осмотического давления раствора, содержащего произвольную смесь растворенных веществ, по величине понижения температуры замерзания (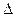 t) этого раствора по сравнению с температурой замерзания растворителя.
t) этого раствора по сравнению с температурой замерзания растворителя.
15. Перечислите основные положения теории Аррениуса.
16. Приведите классификацию Аррениуса электролитов по силе.
17. Сформулируйте теорию кислот-оснований Аррениуса.
18. Что такое константа диссоциации? Как это понятие связано с константой равновесия?
19. Что является ограничением в теории Аррениуса?
20. Запишите математическую формулировку закона разбавления Оствальда.
21. Каков физический смысл изотонического коэффициента Вант Гоффа?
22. Выведите уравнение, позволяющее понять физический смысл изотонического коэффициента.
23. Сформулируйте основные положения теории Бренстеда-Лоури.
24. Приведите классификацию растворителей по Бренстеду-Лоури.
25. В чем сущность количественной теории влияния растворителей на силу кислот, предложенной Н.А. Измайловым? Какую роль в этой теории играет водородная связь?
26. Каковы основные положения теории Льюиса?
27. Можно ли назвать теорию Льюиса "электронной"?
28. Что такое "ионная сила раствора"? Как может это понятие использоваться для описания свойств раствора?
29. Объясните физический смысл коэффициента активности?
30. Что является основной теоретической идеей теории Дебая - Хюккеля?
31. Приведите математическое выражение для расчета толщины ионной атмосферы.
32. Приведите математическое выражение для расчета коэффициента активности по Дебаю-Хюккелю в первом приближении.
33. Что такое "предельный закон" Дебая?
34. Приведите математическое выражение для расчета коэффициента активности во втором приближении по Дебаю-Хюккелю.
35. Приведите третье приближение теории Дебая-Хюккеля.
V. ОБЯЗАТЕЛЬНЫЕ ДЛЯ ВЫПОЛНЕНИЯ ЗАДАНИЯ:
Примеры решения задач
Пример 17-1 Раствор, содержащий 0,872 кмоль/м3 тростникового сахара, при 290 К изоосмотичен с раствором, содержащим 0,5 кмоля/м3 хлорида натрия. Определите кажущуюся степень диссоциации и изотонический коэффициент Вант-Гоффа для указанного раствора хлорида натрия.
Решение
Для раствора сахара осмотическое давление можно рассчитать по уравнению p=c1RT, где с1 - молярная концентрация сахара в растворе:
p = с1RT
Для раствора хлорида натрия осмотическое давление равно:
p = iс2RT,
где с2 — молярная концентрация хлорида натрия в растворе, i — изотонический коэффициент, учитывающий диссоциацию электролита в растворе.
Так как по условию задачи осмотические давления для этих растворов равны, то c1RT = ic2RT.
По уравнению i =l + a(n - 1) находят степень диссоциации хлорида натрия. Молекула последнего в растворе распадается на два иона, поэтому n = 2.
Ответ: 74,4%.
ЗАДАЧИ
17-1. Заполните таблицу, вписав в соответствующие графы необходимые уравнения для растворов электролитов:
| № | Вид эффекта | Уравнение |
| 1. | Криоскопический эффект | |
| 2. | Эбулиоскопический эффект | |
| 3. | Осмос | |
| 4. | Уравнение предельного закона Дебая. | |
| 5. | Второе приближение уравнения Дебая. | |
| 6. | Третье приближение уравнения Дебая. |
17-2. Изотонический коэффициент в водном растворе хлоруксусной кислоты (СН2ClСООН) с моляльностью 0,03 моль/кг равен 1,21. Что означает эта величина? Чему равны степень диссоциации хлоруксусной кислоты ( ) и понижение температуры замерзания раствора (
) и понижение температуры замерзания раствора ( ), если Ккр (Н2О) = 1,86.
), если Ккр (Н2О) = 1,86.
Ответ:  = 0,21,
= 0,21,  = 0,07 ОС
= 0,07 ОС
17-3. При какой температуре кристаллизуется лед из 0,3% раствора хлорида натрия, если считать соль полностью диссоциированной. Криоскопическая постоянная воды 1,86° К -кг/ моль.
Изобразите графически зависимость р= f(t) для равновесия пар — жидкая вода, пар — лед, пар — раствор.
Ответ: Kкр = 0,191 °С
17-4. Оцените кажущуюся степень диссоциации иодида калия в 1%-ном водном растворе, если понижение температуры замерзания этого раствора составляет 0,207°.
Ответ: a = 0,849
17-5. Во сколько раз отличаются величины понижения температуры замерзания следующих веществ при одинаковой моляльности растворов: глюкоза, хлорид калия, сернокислый магний, карналлит (KCl×MgCl2 6H2O).
Ответ: 1:2:2:5.
17-6. 3%-ный водный раствор СаС12 имеет температуру кипения 373,50 К. Определите, при какой температуре будет замерзать этот раствор, каково значение величины i.
Ответ: Т = 271,95 К; i = 2,35.
17-7. Раствор содержит три вещества: глюкозу, хлористый натрий, хлористый кальций в количестве по 1,8 г каждого в 100 г смешанного раствора. Кажущиеся степени диссоциации: 0,82 (NaCl) и 0,72 (СаС12). Каково понижение температуры замерзания этого раствора?
Ответ: DТ = 2,076°.
17-8. Рассчитайте изотоническую концентрацию хлорида натрия (массовую долю, %) в физиологическом растворе, если известно, что осмотическое давление крови человека составляет 7,7×105 Па (T = 310 К). Изотонический коэффициент раствора хлорида натрия примите равным 1,86.
Ответ: 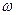 = 0,9%.
= 0,9%.
17-9. Определите концентрацию водного раствора глюкозы, если этот раствор при 291 К изоосмотичен с раствором, содержащим 5×102 моль/м3 хлорида кальция, причем кажущаяся степень диссоциации последнего при указанной температуре составляет 65,4%.
Ответ: С= 1,154 моль/л.
17-10. Раствор, содержащий 1,632×103 кг трихлоруксусной кислоты в 0,1 кг бензола, кристаллизуется при температуре: на 350 К ниже, чем чистый бензол. Определите, происходит диссоциация или ассоциация трихлоруксусной кислоты в бензольном растворе. Криоскопическая константа бензола равна 5,16 К кг/моль.
17-11. Раствор, содержащий 0,001 моля хлорида цинка в 1 кг воды, замерзает на 0,0055 К ниже, чем чистая вода; а раствор, содержащий 0,0819 моля в 1 кг воды, замерзает на 0,385 К ниже, чем чистая вода.
Вычислите изотонический коэффициент i для обоих растворов и объясните, почему он различен? Криоскопическая константа для воды 1,86 К кг/моль.
Ответ: i1 =2,96, i2 = 2,53.
17-12. Понижение температуры замерзания раствора, содержащего 0,9705 валериановой кислоты в 0,1 кг воды составляет 0,181 К. Покажите, что эта кислота в растворе слабо диссоциирована.
17-13. Рассчитайте концентрацию раствора хлорида кальция который изотоничен 0,5 моль/кг Н2О раствору глюкозы, вычислите температуру замерзания этого раствора. Примите степень диссоциации соли равной 81,3%.
Ответ: b = 0,19 моль/кг; Tзам=271,299 К,
17-14. Рассчитайте кажущуюся степень диссоциации MgCl2 в 1 моль/дм3 раствора, если осмотическое давление этого раствора в 4,7 раза больше осмотического давления 3,05 моль/дм3 раствора мочевины.
Ответ: a= 67,5%.
17-15. Рассчитайте осмотическое давление природного солевого раствора, содержащего массовую долю NaCl - 2,12%, MgCl2 - 3,05%, CaCl2 - 0,38%, если плотность раствора 1061 кг/м3. Изотонические коэффициенты равны 1,86; 2,41 и 2,56, соответственно. Температура 310 К.
Ответ: p = 4,191
VIII. ПЛАН РАБОТЫ НА ПРЕДСТОЯЩЕМ ЗАНЯТИИ:
1. Контроль и коррекция выполнения домашнего задания.
2. Разбор основных теоретических вопросов темы.
3. Решение задач.
4. Тестовый контроль.
5. Выполнение лабораторных работ:
1) «Определение осмотической концентрации и осмотического давления раствора хлорида натрия» и
2) «Определение молярной массы мочевины».
Лабораторная работа № 11






