К О Н Е Ч Н А Я Ц Е Л Ь З А Д А Н И Я:
На основе данных криометрического метода анализа уметь рассчитать:
I. Молярную массу растворенного вещества.
II. Степень диссоциации электролита.
Задание 1. Рассчитайте молярную массу растворенного вещества, используя данные таблиц №1 и №2.
Таблица 1.
| № зад. | Раствори- тель | Навеска растворителя mA, г | Навеска раство- ренного вещества mB, г | Темпера- тура за- мерзания раство- рителя | Темпера- тура за- мерзания раствора |
| T1, 0С | t2, 0C | ||||
| 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. | бензол бензол бензол бензол вода вода вода вода камфора камфора укс.к-та укс.к-та | 100 50 25,46 20 200 50 51 50 10 25 100 25 | 2,52 0,935 0,813 0,04 7,25 0,625 12,6 1.0 0,416 0,520 2,580 0,123 | 5,45 5,45 5,45 5,45 0 0 0 0 178,5 178,5 16,68 16,68 | 4,41 4,82 4,17 5,383 —0,375 —0,388 —5,0 —0,81 165,5 172,34 15,86 16,34 |
| № п/п | Вещество | Криоскопическая константа, Ккр |
| 1. 2. 3. 4. | Вода Бензол Уксусная кислота Камфора | 1,86 5,12 3,90 40,0 |
Задание 2. Рассчитайте степень диссоциации электролита в водном растворе, используя данные таблиц №2 и №3. Температура замерзания воды (t1) 00С.
Таблица 3.
| № зад. | Растворенное вещество | Навеска раствори- теля mA, г | Навеска растворенного вещества mB, г | Температура замерзания раствора t2 0С |
| 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. | CH2ClCOOH KOH ZnCl2 Zn(NO3)2 CaCl2 Al2(SO4)3 ZnCl2 Na2SO4 BaCl2 CH3COOH K2SO4 KCN | 100 100 250 100 99,5 100 100 100 50 25 25 500 | 0,262 14,0 1,7 1,23 0,5 17,1 27,2 19,46 6,2 1,51 2,4 3,0 | —0,062 —7,44 —0,23 —0,32 —0,253 —4,19 —5,49 —4,84 —2,97 —1,92 —2,79 —0,32 |
Свойства разбавленных растворов подчиняются закону Рауля. Следствием закона Рауля является криоскопический эффект — понижение (Dt3) температуры замерзания раствора (t2) по сравнению с температурой замерзания чистого растворителя (t1):
Dt3 = t1 – t2
Dt3 = Ккр в – для разбавленных растворов неэлектролитов
Dt3 = i Ккр в – для разбавленных растворов электролитов
Ккр – криоскопическая постоянная
в – моляльность растворенного вещества в растворе,
i – изотонический коэффициент
Если для приготовления раствора взяты навески растворенного вещества – mB, г и растворителя mA, г, то моляльность вещества в растворе можно рассчитать по равнению:

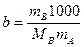 ,
,
где MB – молярная масса растворенного вещества.
Определяя величину Dt3, можно:
1. По уравнению (для растворов неэлектролитов) рассчитывать молярную массу растворенных веществ.

2. По уравнению (для растворов электролитов) рассчитать изотонический коэффициент
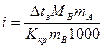 ,
,
который связан со степенью диссоциации соотношением:

где n – число ионов, на которые распадается молекула электролита в результате электролитической диссоциации.
Л И Т Е Р А Т У Р А
1. Евстратова К.И., Купина Н.А., Малахова Е.Е. Физическая и коллоидная химия. М.: Высшая школа, 1990.
2. Физическая химия/ Под ред. К.С. Краснова, М.: Высшая школа, кн.1, 2001.
3. Киреев В.А. Курс физической химии. М.: Химия, 1978.
4. Стромберг А.Г., Семченко Д.П. Физическая химия. М: Высшая школа, 1999.
5. Голиков Г.А. Руководство по физической химии. М.: Высшая школа, 1988.
6. Климов И.И., Филько А.И. Сборник вопросов и задач по физической и коллоидной химии. М.:Просвещение, 1975.
7. Краткий справочник физико-химических величин / Под ред. А.А. Равделя и А.А. Пономаревой. 8-е изд. Л.: Химия, 1983.
8. Практикум по физической и коллоидной химии / Под ред. К.И. Евстратовой, М.: Высшая школа, 1990.
9. Задания по физической химии для самостоятельной работы студентов под контролем преподавателя (часть I) /Под ред. К.И. Евстратовой. Л.: ЛХФИ, 1991.
10. Задачи по физической химии (часть I) /Под ред. В.В. Лунина, М.: МГУ, 2000.
11. Справочник химика / Под ред. Б.Н. Никольского, 2-е изд., Т.1-4, Л.: Химия, 1961-1968.






