A. NaOH спирт. раствор
B. H2SO4 конц.
C. NaOH водн. раствор
D. H2O
E. NaОCl
Атомы галогенов выступают в качестве заместителя в бензольном кольце и влияют на направление и скорость реакций электрофильного замещения. Выберите соединение, является продуктом реакции



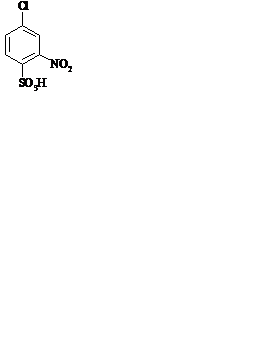
A. B. C.

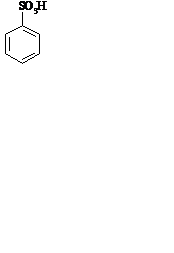
D. E.
8. Для получения ароматических галогенпроизводных используют способ галогенирования алкил аренов. Добавить формулы реагента и катализатора, необходимые для синтеза п-хлортолуолу соответствии со схемой:

A. CH3Cl і NaOH
B. CH3Cl і CH3COOH
C. CH3Cl і CH3COONa
D. Cl2 і NaOH
E. Cl2 і AlCl3
9. Присоединение галогеноводородов к ароматическим галогеналканов проходит по правилу Марковникова:

Укажите механизм данной реакции:
A. SE электрофильное замещение)
B. AN (нуклеофильное присоединение)
C. AE (электрофильное присоединение)
D. SR (радикальное замещение)
E. E1 (мономолекулярное отщепление)
Эталоны ответов:
1.D, 2.E, 3.B, 4.E, 5.B, 6.C, 7.A, 8.E, 9.C.
Тема №10
НИТРОСОЕДИНЕНИЯ, АМИНЫ
АКТУАЛЬНОСТЬ ТЕМЫ
Нитросоединения и амины - относительно токсичные вещества и относятся к клеточным ядам общего действия, особенно опасными для печени. Но они имеют большое промышленное значение. Нитросоединения и амины - промежуточные продукты в производстве синтетических красителей, моющих средств, ингибиторов коррозии, полимеров, инсектицидов, гербицидов, адсорбентов и лекарственных препаратов. Ряд нитросоединений и аминов используется в качестве биологически активных веществ.
Современная фармацевтическая промышленность широко использует нитросоединения, амины и их производные для создания лекарственных препаратов. Например, на основе нитросоединений, имеющих антибактериальное действие, созданы лекарственные средства такие как левомицитин, синтомицина, фуразолидон и др. Амины является структурным фрагментом большой группы лекарственных препаратов известных под названием сульфаниламиды.
ЦЕЛИ ОБУЧЕНИЯ
Общая цель: Уметь определять химические свойства нитросоединений в аминов для применения в фармацевтических и токсикологических исследованиях.
Конкретные цели
Уметь:
1. Различать первичные, вторичные и третичные амины и нитросоединения.
2. Составлять названия аминов и нитросоединений.
3. Выбирать способы добывания аминов и нитросоединений.
4. Определять химические свойства аминов и нитросоединений.
СОДЕРЖАНИЕ ОБУЧЕНИЯ
1. Основные теоретические вопросы:
1. Понятие о нитросоединения. Электронное строение нитрогруппы.
2. Классификация, номенклатура и изомерия нитросоединений
3. Способы получения нитросоединений алифатичного и ароматического ряда
4. Химические и физические свойства нитроалканов и нитроаренив
- Влияние нитрогруппы на реакционную способность углеводородного радикала;
- Нитро- аци- нитротаутомерия и образования солей;
- Взаимодействие с азотистой кислотой;
- Образование нитроалканолив;
- Реакции электрофильного и нуклеофильного замещения (SE, SN) в ряде нитроаренив;
5. Идентификация нитросоединений.
6. Отдельные представители, применение
7. Классификация, номенклатура и изомерия аминов.
8. Способы получения алифатических и ароматических аминов.
9. Физические и химические свойства аминов:
- Кислотно-основные свойства;
- Нуклеофильный характер аминогруппы;
- Алкилирование, ацилирование и N-галогенирования;
- Изонитрильна проба;
- Влияние аминогруппы на реакции електофильного замещения (SE) в ароматическом ядре
- (Галогенирование, нитрование, сульфирование);
- Образование азометинов;
- Отношение аминов к действию окислителей.
10. диаминов. Получение, свойства.
11. Идентификация аминов
12. Отдельные представители, применение
2. Основные термины и их определения
Нитросоединениями называют производные углеводородов, имеющие в своем составе одну или несколько нитрогрупп -NО2. Нитрогруппа имеет плоскую строение, атомы азота и кислорода находятся в состоянии sp2-гибридизации. Один из атомов кислорода соединен с атомом азота двойной связью, а другой - Семиполярная связью (от англ. Semi - наполовину).
Классификация. В зависимости от природы углеводородного радикала, с которым связана нитрогруппа, различают:
-алифатические нитросоединения (насыщенные - нитроалканов, ненасыщенные - нитроалкены, нитроалкины),
-ароматические нитросоединения (соединения, содержащие нитрогруппу, связанную с ароматическим ядрм и соединения, содержащие нитрогруппу в боковом цепи)
В зависимости оттого, у которого (первичного, вторичного, третичного) атома углерода находится нитрогруппа, нитросоединения бувают:


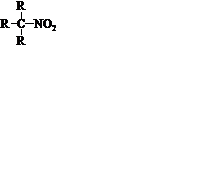
первичные вторичные третичные
Нитроалканы - бесцветные жидкости или вещества желтого цвета, имеют приятный запах, ядовитые, малорастворимые в воде, растворимые в большинстве органических растворителей.
Способы получения нитроалканов:
1. Нитрование алканов (реакция Коновалова). Реакция протекает по радикальному механизму с разбавленной азотной кислотой.

2. Действие солей азотной кислоты на галогенопроизводные углеводородов.

3. Окисление трет-алкиламинов. По данным способом получают исключительно третичные нитросоединения.

Химические свойства нитроалканов. Для нитросоединений характерны два вида реакций: реакции с участием нитрогруппы и реакции с участием подвижных атомов водорода при a-атоме углерода.

1. Таутомерия. Присуща только для первичных и вторичных нитроалканов.

2. Образование солей. Первичные и вторичные нитроалканов растворяются в растворах щелочей с образования солей нитроновых кислот

3. Взаимодействие с азотистой кислотой. Первичные нитроалканов образуют алкилнитролови кислоты, соли которых с щелочными металлами имеют красную окраску.

Вторичные нитроалканов образуют псевдонитролы, имеющие синюю окраску.

Третичные не реагируют с азотной кислотой.
4. Реакция конденсации с альдегидами и кетонами. Реакция характерна только для первичных и вторичных нитроалканов. Для первичных она пртикае в конце, для вторичных она - только на первом этапе.

5. Восстановление. В результате реакции образуются алкиламины.

Нитроарены - это жидкие или кристаллические, бесцветные и окрашенные в желтый цвет вещества с приятным запахом горького миндаля, не растворимые в воде, имеют высокие температуры кипения и плавления.
1. Нитрование аренов. Метод получения ароматических нитросоединений. Реакция протекает по электрофильным механизмом в присутствии серной кислоты.

2. Введение нитрогруппы в боковую цепь (реакция Коновалова)







