Биофармация как наука, не исключая существующих методов оценки качества лекарств (физико-химические показа-тели, в т.ч. идентификация и количественное определение действующих веществ, органолептические свойства) предлагает свои, специфические методы, позволяющие уже на первых этапах исследования исключить возможность выпуска терапевтически неадекватных лекарств. Важнейшим показа-телем, предлагаемым биофармацией, является фармацевти-ческая доступность (или тест растворимости, согласно старой терминологии), выражающая в количественных величинах (параметрах) степень, в которой действующее вещество высвобождается (растворяется) из лекарственного препарата и скорость, с которой этот процесс происходит.
Фармацевтическая доступность (ФД) - (тест раствори-мости) логически и закономерно связана с биологической (физиологической) доступностью, выражающей степень, в которой вещество всасывается (поступает) из места введения в системный кровоток, и скорость, с которой, этот процесс происходит, так как процессы высвобождения (растворения) предшествуют процессам всасывания.
Процесс высвобождения вещества - переход его в растворенном виде из лекарственного препарата в растворяю-щую среду - с некоторым приближением описывается известным уравнением диффузии:
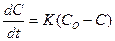 , где:
, где:
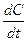 - скорость растворения (высвобождения);
- скорость растворения (высвобождения);
К - константа скорости растворения (высвобождения), мин-1, час-1;
Со - исходное содержание вещества в лек. препарате;
С- содержание вещества в препарате через время t.
Проинтегрируем, прологарифмируем и преобразуем это уравнение, получаем:
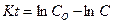 , а учитывая, что С= Со-Сt , где
, а учитывая, что С= Со-Сt , где
Сt - количество вещества, переходящее в раствор за время t
Уравнение записывается следующим образом:
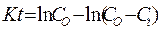 , или
, или 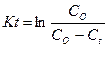
В десятичных логарифмах это уравнение принимает вид:
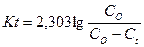
Отсюда константа скорости высвобождения К:
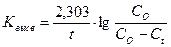
Исходя из полученного уравнения рассчитывают еще один параметр фармацевтической доступности - период полувысво-бождения (t50%):
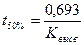 , он выводится:
, он выводится:
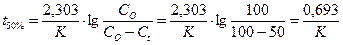 ,
,
Для оценки еще одной величины фармацевтической доступности – степени высвобождения, предложено использо-вать соотношение площадей под кривыми кинетики высвобождения. Последние строятся в системе координат, как
Сt =f(t).
Планиметрическим способом вычисляются площади под кинетическими кривыми высвобождения (растворения) вещества из исследуемого лекарства Sx и для стандартного (сравниваемого) лекарства Sст. Соотношение площадей Sx к Sст выраженное в процентах носит название степени фармацевтической доступности (СФД):
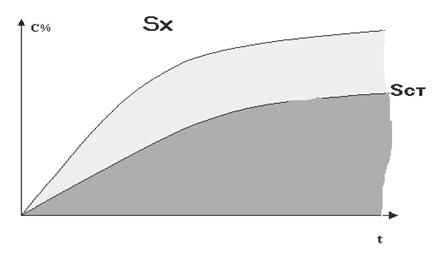 |
Рисунок 3.1
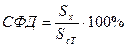
В биофармацевтическом эксперименте убедительно доказано, что отношение площадей под кривыми кинетики высвобождения является степенью полноты высвобождения.
В качестве стандартной лекарственной формы используют истинные (водные) растворы, если же вещество не растворимо в воде - его микрокристаллическую суспензию с хорошо охарактеризованными размерами частиц, агрегативной устойчивостью, степенью и скоростью высвобождения вещества.
На высвобождение вещества из лекарственных препаратов в раствор влияют различные переменные - температура, состав и количество растворителя, интенсивность перемешивания, устройство аппаратуры и др., которые четкo стандартизуются для получения воспроизводимых результатов.
Базируется высвобождение лекарственного вещества в основном на процессе диффузии. Для всех твердых, мягких формированных лекарственных форм в основе методов определения высвобождаемости лежит принцип дезинтеграции (механического разрушения, размягчения, плавления и т.д.) с последующей диффузией включенного в них лекарственного вещества в растворяющую среду. В качестве последней используется вода, физиологический раствор, искусственный кишечный или желудочный сок и т.д.
 |
Чаще определение кинетики высвобождения проводится в обычной аппаратуре для распадаемости лекарственных форм, при этом анализируют количество лекарственного вещества в интервалах времени диффундирующего из целых или распавшихся лекарственных форм в определенный объем жидкости (среда растворения). Количество растворенного лекарственного вещества в процентах во времени представляет графически как „кривую растворения'' — кривую высвобождения.
Рисунок 3.2
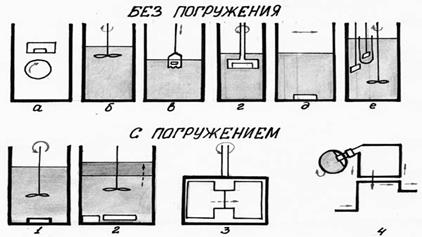
Схемы приборов для определения скорости растворения динамическими методами.
В ряде конструкций приборов (рисунок 3.2) растворяющая среда не удаляется из емкости прибора на протяжении всего времени определения. Приборы, представляющие собой термостатируемые при 37°С емкости с различными мешалками и заполненные растворяющей средой - приборы с пропеллерной, трехлопастной и другими видами мешалок, с качающейся корзинкой, с пробирками, закрепленными на вращающемся диске, со встряхиваемой с частотой 65 колебаний в секунду колбе и др.
К рисунку 3.2
| а) прибор Wruble б) прибор с мешалкой пропеллерной в) прибор с качающейся корзинкой г) качающийся сосуд д) прибор Sauder n Ellenbogen е) прибор Edmundson n Lees | 1)прибор Wrsten n Poll 2)прибор с раздели-тельной мембраной 3)прибор-диализатор с враща-ющейся ячейкой (склян-кой) 4) прибор Krogerus |
Рисунок 3.3
Прибор для определения скорости растворения
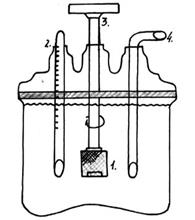
1) проволочная корзинка с таблеткой
2) термометр
3) мотор
4) трубка для забора проб
К таковым приборам отно-сится широко применяемое в настоящее время (выпускается отечественной промышлен-ностью) устройство с качаю-щейся корзинкой.
Для оценки растворения используют прибор "вращаю-щаяся корзинка". Основной частью прибора является цилиндри-ческой формы сетчатая корзинка с отверстиями диаметром 0,25 мм в которую помещают испытуемый образец. Корзинка вращается в среде растворения (объем до 1л) со скоростью 50 -200 об/мин. С помощью термостата поддерживается темпера-тура 37°С±1°С.
Среда растворения - вода, растворы кислоты хлороводоро-дной, буферные среды с различными значениями рН и др. Испытуемый образец (таблетку или капсулу) помещают в сухую корзинку, которую опускают в среду растворения, так, чтобы расстояние до дна сосуда было 20 +2 мм. Сосуд накрывают крышкой, затем приводят во вращение, режим которого обусловлен в частной статье или составляет 100 об/мин.
Через время, указанное в частных статьях, или через 45 минут отбирают пробу раствора, которую фильтруют через фильтр "Владипор" или "Миллипор" с диаметром пор 0,45 мкм. В фильтрате проводят количественное определение действую-щего вещества.
Для каждой серии лекарственной формы рассчитывают количество вещества, перешедшего в раствор (в % от содержания в таблетке или капсуле, которое принимают за 100%), как среднее для 5 таблеток или капсул.
Серия считается удовлетворительной если при растворе-нии в воду перешло за 45 минут (при режиме перемешивания 100 об/мин) в среднем не менее 75% действующего вещества от содержания в лекарственной форме.
Существенным недостатком метода определения раствори-мости является его длительность. Время, необходимое для выполнения определений этого типа, конечно, зависит от растворимости вещества и от метода анализа, используемого для количественного определения вещества в растворе. В идеальных условиях на определение теста растворимости одной таблетки требуется не более одного часа. Но редко испытания проводятся только для одной таблетки, или другой моделированной лекарственной формы.
Так, фармакопея USP устанавливает, что характеристики растворения 6 таблеток или капсул должны быть определены индивидуально. Если все 6 величин растворения соответствуют требованиям, то партия принимается. Если 1 или 2 из 6 образцов не удовлетворяет требованиям, то еще 6 таблеток дополнительно должны быть проверены на растворимость. Из 12 полученных величин 10 должны удовлетворять требованиям растворимости.
 Германская фирма "Эрвека" выпускает прибор, позволяю-щий одновременно определять растворимость 6 образцов. Он состоит из 6 колб вместимостью 100 мл, помещенных в общую водяную баню. Платформа поддерживает 6 корзинок и их моторчики. Общий мотор приводит в движение корзинки (постоянная скорость их вращения обеспечивается тахометри-ческим генератором), скорость вращения указывается на циферблате в об/мин.
Германская фирма "Эрвека" выпускает прибор, позволяю-щий одновременно определять растворимость 6 образцов. Он состоит из 6 колб вместимостью 100 мл, помещенных в общую водяную баню. Платформа поддерживает 6 корзинок и их моторчики. Общий мотор приводит в движение корзинки (постоянная скорость их вращения обеспечивается тахометри-ческим генератором), скорость вращения указывается на циферблате в об/мин.
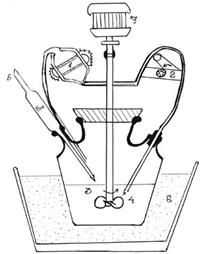
Рисунок3.4
Прибор для определения скорости растворения в проточной ячейке
1) проточная ячейка
2) насос
3) трехлопастная мешалка
4) всасывающий патрубок
5) пипетка для отбора проб
6) водяная баня
7) мотор
Было предложено также проводить автоматический отбор проб. Впервые прибор с автоматическим отбором проб для анализа описан в 1962 г. (Schroeter L.C.). Он был основан на приборе, предложенном Гершбергом и Штоллем ("качающаяся корзинка") для определения распадаемости таблеток. В определенные интервалы времени пробы среды растворения отбирались на анализ при использовании фильтрующего устройства и насоса, пропускались через проточную кювету спектрофотометра, где автоматически анализировались и затем возвращались в сосуд растворения. При этом профиль растворения воспроизводился на самописце, соединенном со спектрофотометром.
У других автоматизированных моделей аппаратов среда растворения при помощи насоса переносится в проточную кювету спектрофотометра, где автоматически определяется и регистрируется количество высвободившегося лекарственного вещества. Общий вид устройства дан на рис 3.4
К недостаткам указанных методов при их простоте конструкции и удобстве использования относится ингибиру-ющее (замедляющее) влияние на высвобождение (растворение) вещества уже растворенного в среде первоначального его количества. Ингибирующее влияние на скорость растворения уже растворенного вещества можно устранить в приборах, в которых предусмотрено постоянное удаление из растворяющей среды вещества, переведшего в раствор.
В приборах этого типа используются:
а) адсорбционные;
б) разделительные;
в) диализные методы.
АДСОРБЦИОННЫЙ МЕТОД основан на поглощении высвободившегося вещества каким-либо адсорбентом (активированный уголь, бентонит, силикогель и др.) с последующим количественным определением вещества в таковом. Этот метод в настоящее время не получил широкого распростра-нения.
В РАЗДЕЛИТЕЛЬНОМ МЕТОДЕ используется способ-ность вещества, высвободившегося в водную фазу, переходить в липофильную фазу, в качестве которой чаще применяется органический растворитель, несмешивающийся с водой (например, хлороформ).
Примером является прибор Resomat I (рис. 3.5), где высвобождение лекарственного вещества из исследуемой лекарственной формы проходит в водную фазу при постоянно меняющемся значении ее рН (от I,2 до 7,8). Этим пытаются имитировать среду желудочно-кишечного канала. Водная фаза находится в гидростатическом равновесии с липофильным растворителем (хлороформ). Слой разделения вода/хлороформ представляет при этом модель липидной мембраны. Высвобождающееся в воду вещество непрерывно, под действием давления проникает через специальный фильтрую-щий материал (туфовый фильтр) и вступают в контакт с хлороформом. Распределение лекарственного вещества ускоряет быстро вращающийся пограничный слой, что достигается с помощью магнитной мешалки. В связи с постоянным переходом растворенного вещества из водной фазы в хлороформную, водная фаза сохраняет основные динамические свойства, характерные для непрерывного процесса всасывания вещества в желудочно-кишечном тракте. Увеличение концентрации вещества в липофильной фазе соответствует приблизительно прогрессирующему всасыванию. Непрерывно или через выбранные интервалы времени спектрофотометрически определяется концентрация веществ в хлороформе. При отборе проб хлороформный раствор постоянно пополняется чистым растворителем.
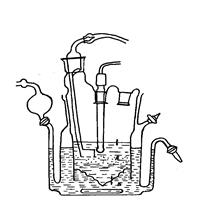
Рисунок 3.5
Прибор Resomat I
Среди трехфазных методов наиболее интересны липидмембранные аппараты. В аппаратах этого типа лекарственное вещества диффундирует из искусственного желудочного (рН 1,5) или кишечного сока (рН 7,6) через искусственную липидную мембрану (липидный барьер) в искусственную плазму, сыворотку крови с рН 7,4 (прибор Resоmat-II).
В связи с тем, что перенос лекарственных веществ через масляный слой (липиды) происходит медленно, в качестве моделей липидного барьера используют некоторые неполярные жидкости (хлороформ, пентан, гексан, толуол, бензол и др.).
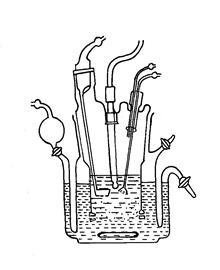
Рисунок 3.6
Прибор Resоmat-II
В аппарате Resоmat-II (рис.3.6) (с жидкой липидной мембраной) таким образом две водные фазы (искусствен-ный сок и сыворотка крови) разделяются друг от друга через органическую жид-кость. При этом интенсив-ность переноса вещества определяется коэффициентом распределения вещества в системе липид-раствор лекарствен-ного вещества в искусственном желудочном или кишечном соке.
Фирма "САРТОРИУС" выпускает установку, включаю-щую две модели, которые позволяют изучать скорость растворения и скорость всасывания лекарственных веществ и устанавливать зависимость скорости всасывания от растворимости твердого лекарственного вещества в желудочно-кишечном тракте.
Моделью этой установки по определению растворимости (или камера растворения) обеспечивает проведение исследо-ваний в условиях, которые близко моделируют условия желудочно-кишечного тракта. Чтобы смоделировать прохожде-ние вещества из желудка в кишечник, искусственный желудочный сок (рH 1,2), находящийся в камере растворения, через 30 мин превращают в искусственный кишечный сок (рН 6,5).
Соответствующим образом рН искусственного кишечного сока в камере можно непрерывно изменять в течение экспери-мента. Во время испытания камера растворения (ее емкость 100 мл) вращается вокруг горизонтальной оси, имитируя, таким образом, перистальтическое движение кишечника и желудка. По мере растворения лекарственного вещества определенный объем содержимого камеры (1-2 мл) через промежутки времени автоматически подается на фильтр. Идентичный объем соответствующего буфера (искусственного желудочного или кишечного соков) вытекает из камеры наполнения в камеру растворения, где объем жидкости во время испытания остается постоянным (100 мл).
Вторая модель всасывания установки "САРТОРИУС" состоит из диффузионной камеры с двумя отсеками, разделен-ными посредством особого липидного барьера. В один из отсеков помещается искусственный желудочный сок или кишечный, в которых растворено испытуемое вещество, а в другой 100 мл искусственной плазмы (рН 7,4). Как в Resomat II, барьер липида состоит из инертной основы (мембранный фильтр "САРТОРИУС), поры которой наполнены жидкой липидной фазой.
Важной чертой прибора "САРТОРИУС" является то, что барьер липида проницаем к "пассивно" передаваемым лекарственным веществам (аналогично проницаемости желу-дочных и кишечных стенок). В ходе диффузии лекарственного вещества в искусственную плазму определяют константу скорости диффузии, которая является пропорциональной соответствующей константе скорости всасывания.
Полуавтоматический принцип действия прибора "САРТОРИУС" позволяет использовать его для контроля качества лекарств. Он может быть полезным при разработке технологии твердых лекарственных форм (таблетки, гранулы, порошки, суспензии), так как обеспечивает информацией о том, как изменяется скорость высвобождения лекарственного вещества из лекарственной формы в зависимости от фармацевтических факторов и как это влияет на скорость всасывания.
Интересны динамические методы с циркулирующей жидкостью, которые являются принципиально новыми. При динамических методах липид проходит в виде мелких капель через водную фазу, представляющую искусственную желудоч-ную среду, затем через нейтральную водную фазу, соответствующую сыворотке крови, жидкостные фазы (липид-водные фазы) при этом соприкасаются на большой поверхности и поэтому при этих методах наблюдается очень быстрый транспорт веществ из одной системы (водной) в другую (липид).
Наиболее простым и широко распространенным методом при определении интенсивности высвобождения (растворения) является диализный метод. В качестве диализной мембраны используют пленку из полимерных материалов различной природы - этилцеллюлозы, силиконового каучука, полиамидных смол, полидиметилсилоксана и др.
Аппаратурное оформление метода представлено прибо-ром, предложенным Мuhlemann u Neuenschwander и несколько модифицированным Krowczynski. Описание прибора приведено в учебнике И.А. Муравьева, 1980,ч.1, с 296.
Прибор состоит из стеклянной трубки длиною 15 см, сечением 10см2, на одном конце которой закреплена целлофа-новая мембрана. Трубка с мембраной погружена (на глубину 2-3 мм) в термостатируемый сосуд, содержащий 20-30 мл раство-ряющей среды. На целлофановую мембрану помещают лекарственную форму (суппозиторий, мазь) равномерным слоем. Через определенные промежутки времени, с момента начала диализа, проводят отбор проб с помощью пипетки, в которых (пробах) анализируют количество высвободившегося вещества.
В качестве диализной мембраны используют также изолированный отрезок толстого кишечника крыс. Инкубированные отрезки толстого кишечника крыс сохраняют жизнеспособность, резорбционные и ферментативные свойства в течение двух часов. Изолированный отрезок с помещенной лекарственной формой погружают в раствор Рингер-Локка или другой физиологический раствор, в котором и проводят анализ выделившегося (всосавшегося) вещества.
Высвобождение лекарственного вещества из лекарствен-ной формы зависит от природы и количества вспомогательных веществ, степени дисперсности вещества, от его растворимости, рН среды и других факторов. Скорость и полнота высвобождения лекарственного вещества определяется величиной Квысв. Именно эта константа, предшествуя процессу всасывания, часто лимитирует его, особенно если лекарство находится в форме таблеток, капсул, драже, спансулу, суспензий, порошков, суппозиториев и др. С увеличением Квысв, то есть c увеличением количества высвободившегося вещества из лекарственной формы в раствор, полнее будет проходить и дальнейший процесс всасывания.
Ингибирующее влияние на скорость растворения уже растворенного вещества можно устранить в приборах, в которых предусмотрено постоянное удаление из растворяющей среды вещества, перешедшего в раствор.
Лекция 4.






