Алкины – непредельные углеводороды с одной тройной связью в молекуле и общей формулой  .
.
 Тройная связь состоит из одной σ - связи и двух π - связей. Молекула ацетилена линейна, так как оба атома углерода находятся в состоянии sp- гибридизации. Негибридные p- орбитали атомов углерода перекрываются во взаимно противоположных плоскостях.
Тройная связь состоит из одной σ - связи и двух π - связей. Молекула ацетилена линейна, так как оба атома углерода находятся в состоянии sp- гибридизации. Негибридные p- орбитали атомов углерода перекрываются во взаимно противоположных плоскостях.
Тройная связь является более прочной, чем одинарная или двойная, и поэтому атомы углерода более приближены друг к другу, чем в алканах или алкенах.
Ацетилен – бесцветный газ, практически без запаха, не растворим в воде.
Химические свойства:
1) Реакции присоединения:
а) HC≡CH + H2  H2C=CH2 H2C=CH2 + H2
H2C=CH2 H2C=CH2 + H2  H3C−CH3
H3C−CH3
этин этен этан
б) HC≡CH + Br2 ⟶ BrHC=CHBr CHBr=CHBr + Br2 → CHBr2−CHBr2
1,2-дибромэтен 1,1,2,2-тетрабромэтен
в) HC≡CH + HCl ⟶ CH2=CHCl
хлорвинил O
г) реакция Кучерова: HC≡CH + HOH  CH3−C
CH3−C
уксусный альдегид H
2) Реакции окисления:
2C2H2 + 5O2  4CO2 + 2H2O + Q
4CO2 + 2H2O + Q
При горении ацетилена в чистом кислороде температура пламени ∽3000°.
Получение:
В промышленности:
а) при взаимодействии карбида кальция с водой: CaC2 + 2HOH → Ca(OH)2 + HC≡CH
б) путём термического разложения метана: 2CH4 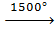 HC≡CH + 3H2
HC≡CH + 3H2
Образовавшийся ацетилен быстро выводят из реактора, чтобы он не разлагался.
Применение:
| C2H2 | 
| CH3−CH=O уксусный альдегид | 
| Уксусная кислота и искусственные смолы |

| CH2=CHCl хлорвинил | 
| Поливинилхлорид ПВХ | |
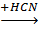
| CH2=CH−C≡N акрилонитрил | 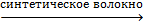
| Полиакрилонитрил ПАН | |

| СН2=ССlСН=СН2 хлоропрен | 
| Специальные каучуки и резины |
Билет №6 (1)
Скорость химических реакций.
Зависимость скорости от природы, концентрации веществ, площади поверхности соприкосновения реагирующих веществ, температуры, катализатора.
Скорость химической реакции 𝓋 определяется изменением концентрации реагирующих веществ (Δc) за единицу времени (Δt)
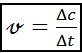 ,
, 
Основные факторы, влияющие на скорость:
| № | Условия | Примеры |
| 1. | Природа реагирующих веществ | 1) 1) 2Na + 2H20 → 2NaOH + H2 2K + 2H2O → 2KOH + H2 2) 2) Mg + 2HCl → MgCl2 + H2 Zn + 2HCl → ZnCl2 + H2 т.к. K>Na, Mg>Zn (см. ряд напряжений) |
| 2. | Для реакций в гомогенных фазах от концентрации | 2C2H2 + 5O2 → 4CO2 + 2H2O горение на воздухе (20% О2) коптящим пламенем, а в чистом кислороде ярким пламенем. |
| 3. | Для веществ в твёрдом состоянии – от площади поверхности | CaCO3 + 2HCl → CaCl2 + H2O + Cl2 горение большого полена и маленьких щепочек, кусок мела и порошок мела с соляной кислотой. |
| 4. | От температуры. При повышении температуры на каждые 10° скорость химических реакций увеличивается в 2 – 4 раза (правило Вант-Гоффа) | 2Cu + O2→2CuO медленное окисление (долгий процесс, при обычной температуре) и горение (быстро, с выделением теплоты). Приготовление пищи. |
| 5. | От присутствия катализатора | 2H2O2  2H2O + O2 MgO2 – катализатор
2KClO3 2H2O + O2 MgO2 – катализатор
2KClO3  2KCl + O2
CH2=CH2 + H2 2KCl + O2
CH2=CH2 + H2  CH3−CH3 Pt(Ni) – кат-р.
этилен этан CH3−CH3 Pt(Ni) – кат-р.
этилен этан
|
Наука, изучающая скорости и механизмы химических реакций,
называется химической кинетикой.
Билет №6 (2)






