Крахмал и целлюлоза относятся к полисахаридам, образуются в природе путём поликонденсации молекул глюкозы.
| № | Признак сравнения | КРАХМАЛ | ЦЕЛЛЮЛОЗА |
| 1. | Формула | (C6H10O5)n | (C6H10O5)n |
| 2. | Тип связи | α (1→4) связи | β (1→4) связи |
| 3. | Строение молекул | ||
| 4. | Состав молекулы | 1) амилоза n=900-8000 строение линейное α (1→4) 2) амилопектин n=6000 – 6.000.000 строение разветвлённое α (1→6) | Только целлюлоза n= от 5000-6000 до 10.000.000 строение линейное |
| 5. | Химические свойства | 1) Подвергается гидролизу:
(C6H10O5) n + n H2O  n C6H12O6
целлюлоза, крахмал глюкоза
Далее сбраживание глюкозы:
C6H12O6 n C6H12O6
целлюлоза, крахмал глюкоза
Далее сбраживание глюкозы:
C6H12O6  2C2H5OH + 2CO2 2C2H5OH + 2CO2
| |
| 2) С йодом даёт ярко синее окрашивание. | 2) Получение эфиров азотной кислоты:
| ||
| 3) Ацетаты целлюлозы:
а) динитро целлюлоза→целлулоид;
тринитро целлюлоза→пироксилин, взрывчатое вещество
б) диацетил целлюлозы:
|
Билет №5 (1)
Обратимость химических реакций.
Химическое равновесие и условия его смещения, практическое применение.
Известно, что химические реакции бывают:
| обратимые | необратимые |
| 2SO2 + O2 ⇄ 2SO3 | C + O2 → CO2 + Q |
Обратимые химические реакции – это реакции, протекающие одновременно в двух направлениях (прямая и обратная реакции).
2SO2 + O2 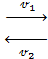 2SO3
2SO3
Если 𝓋1 = 𝓋2, то наступает состояние химического равновесия, то есть такое состояние системы реагирующих и образующихся веществ, когда скорости прямой и обратной равны. Оно может сохраняться долго при постоянных внешних условиях (t, p, c). Но на практике смещение равновесия приводит к увеличению выхода целевого продукта.
Равновесие можно сдвинуть при изменении внешних условий (t, p, c).
Принцип подвижного равновесия Ле Шателье:
При изменении внешних воздействий (t, p, с) равновесие смещается в сторону реакции, противодействующей этому воздействию:
1. Изменение концентрации (с) реагирующих веществ:
2SO2 + O2 ⇄ 2SO3 + Q
При увеличении концентрации O2 система сместит равновесие в сторону расходования O2, то есть в сторону прямой реакции.
2. Изменение температуры. Увеличение температуры ведёт к возрастанию количества теплоты и, следовательно, приводит к реакции разложения, то есть обратной реакции.
3. Изменение давления:
2SO2 + O2 ⇄ 2SO3 Равновесие смещается в сторону низкого давления,
 3 V то есть в сторону прямой реакции.
3 V то есть в сторону прямой реакции.
4. Катализаторы ускоряют прямую и обратную реакции, равновесие наступает быстрее, но не смещается.
Билет №5 (2)
Ацетилен – представитель углеводородов с тройной связью в молекуле.






