Теплоемкостью тела называется величина, равная количеству теплоты dQ, которое нужно сообщить телу, чтобы повысить его температуру на единицу:
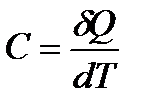 (1)
(1)
Стандартная единица теплоемкости – джоуль на кельвин (Дж/К).
Теплоемкость моля вещества называется молярной теплоемкостью Сm. Измеряется она в джоулях на моль-кельвин (Дж/(моль×К)).
Теплоемкость единицы массы вещества называется удельной теплоемкостью Суд. Измеряется она в джоулях на килограмм-кельвин (Дж/(кг×К)). Удельная и молярная теплоемкости связаны соотношением:
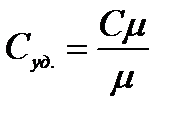
где m - молярная масса. При нагревании твердое тело не совершает работы над внешними телами, так как объем тела практически не меняется. Следовательно, согласно первому началу термодинамики (dq = dU + dА), все тепло идет на приращение внутренней энергии.
На основании (1) получаем:
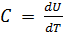 . (2)
. (2)
В твердых телах частицы «закреплены» в определенных положениях равновесия, отвечающих минимуму энергии взаимодействия их друг с другом. Частицы могут совершать только колебания около равновесного положения в узлах кристаллической решетки. Направление колебаний непрерывно и хаотически меняется с течением времени.
В случае химически простых веществ это число равно числу Авогадро:
U m = N A·3 kT = 3 RT, (3)
где R = kN A - универсальная газовая постоянная. Тогда, согласно (2), молярная теплоемкость твердого тела должна быть равна:
C m = 3 R. (4)
Так как R = 8,314 Дж/(моль×K), то С m» 25 Дж/(моль·К). Следовательно, теплоемкость моля химически простых тел в кристаллическом состоянии одинакова и равна 3 R. Это утверждение называется законом Дюлонга – Пти.
Если твердое тело является химическим соединением, например, NaCl, то его кристаллическая решетка построена из атомов различных типов. Если в молекуле n атомов, и каждый атом обладает энергией 3 kТ, то на молекулу придется в среднем энергия 3 nкТ. Молярная теплоемкость будет равна C m = 3 nkN A = 3 nR, т. е. в n раз больше, чем у того же вещества при одноатомной молекуле. В кристалле каменной соли мы имеем расположенными по узлам решетки ионы Na+ и Cl-, общее число которых в моле равно 2 N А.
Молярная теплоемкость кристаллической каменной соли должна равняться С m = 6 kN A = 6 R. В общем случае, молярная теплоемкость твердого соединения равна сумме молярных теплоемкостей элементов, из которых оно состоит, это правило было установлено эмпирически и называется законом Джоуля – Коппа.
Указанные законы выполняются с хорошим приближением для многих веществ при комнатной температуре. При понижении температуры теплоемкость твердого тела уменьшается, стремится к нулю при абсолютном нуле. У алмаза и бора теплоемкость при комнатной температуре оказалась ниже 3 R.
Колеблющийся атом следует уподоблять не классическому, а квантовому осциллятору, обладающему дискретным энергетическим спектром. Энергия линейного осциллятора, согласно квантовой теории, есть целое кратное величины hn/en= nh, где h - постоянная Планка, n – любое целое число. Средняя энергия такого осциллятора вычисляется по формуле Планка:
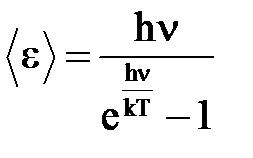 . (5)
. (5)
При высоких температурах, так как hn<< kT, имеем:
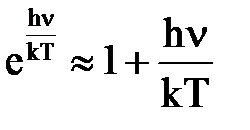
и формула (5) переходит в классическую: <en> = kT.
Основу теории Эйнштейна составляет представление о твердом теле как совокупности N независимых атомов - осцилляторов, колеблющихся с одинаковой частотой n. Средняя энергия, приходящаяся на одну степень свободы осциллятора <e>, определяется формулой (5).
Осцилляторы считаются трехмерными, т. е. имеющими три степени свободы. Поэтому средняя энергия тепловых колебаний одного атома равна 3 < e >, а внутренняя энергия одного моля твердого тела определяется выражением:
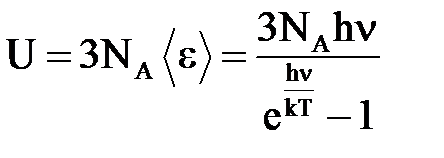 . (6)
. (6)
Отсюда
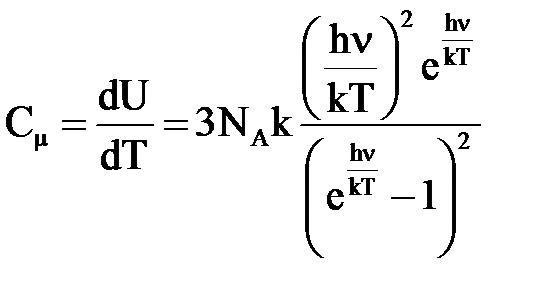 . (7)
. (7)
При больших T (hv/kT << 1) имеем Сμ =3R, т. е. выражение (7) переходит в закон Дюлонга и Пти. В случае низких температур, когда hv/kT >> 1, можно пренебречь единицей в знаменателе (7):
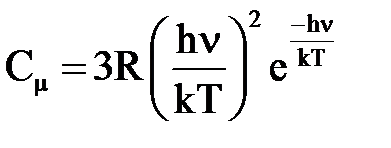 . (8)
. (8)
При Т ® 0 выражения (7) и (8) стремятся к нулю, в полном соответствии с опытом (hn / kT ® ¥; exp(– hn / kT) ® 0). Поскольку экспонента убывает значительно быстрее, то:
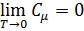
С точки зрения квантовой теории теплоемкости, тот факт, что некоторые вещества (алмаз, бор и другие) не подчиняются закону Дюлонга – Пти даже при комнатных температурах, объяснятся именно тем, что у этих веществ характеристическая температура Дебая настолько высока, что комнатная температура должна считаться низкой температурой (если для серебра q = 210 °С, для алюминия q = 400 °С, для свинца q = 90 °С, то для алмаза q = 2000 °С).
Удельная теплоемкость твердого тела определяется по формуле:
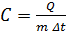 , (9)
, (9)
где С - удельная теплоемкость тела;
Q - количество теплоты, поглощенное образцом при нагревании на  ; m – масса образца; Δ t = t 2 – t 1 – разность конечной и начальной температур.
; m – масса образца; Δ t = t 2 – t 1 – разность конечной и начальной температур.
Если для нагрева пустого калориметра на Δ t требуется количество теплоты Q 1, а для нагрева калориметра с исследуемым образцом на Δ t – количество теплоты Q 2, то на нагрев самого образца идет количество теплоты:
Q обр = Q 2 - Q 1. (10)
В установке ФПТ-8 нагрев производится пропусканием тока через нагреватель. Количество теплоты, выделяемое нагревателем, определяется по закону Джоуля – Ленца:
Q = IU t (11)
I – ток, проходящий через нагреватель; U – напряжение на нагревателе; t – время нагрева.
Если мощность нагрева остается постоянной в течение всего эксперимента, то после подстановки выражения (11) в формулу (10) имеем:
Q = IU × (t2 - t1), (12)
t1 – время нагрева пустого калориметра на Δ t,
t2 – время нагрева калориметра с образцом на Δ t.
Тогда:
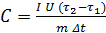 . (13)
. (13)






