II. Описание установки

| Рисунок 1 – Общий вид установки ФПТ1-6н |
III. Методика измерений и расчетные формулы
Состояние некоторой массы газа определяется тремя термодинамическими параметрами: давлением р, объемом V и температурой Т. Уравнение, устанавливающее связь между этими параметрами, называется уравнением состояния. Для идеальных газов таким уравнением является уравнение Клапейрона-Менделеева:
 , (1)
, (1)
где m – масса газа; µ – молярная масса, R = 8,31 Дж/(моль·К) – универсальная газовая постоянная.
Любое изменение состояния термодинамической системы, связанное с уменьшением или увеличением хотя бы одного из параметров р, V, Т, называется термодинамическим процессом.
Изопроцессы – это процессы, протекающие при одном постоянном параметре:
изобарический – при р = const;
изохорический – при V = const;
изотермический – при Т = const.
Адиабатический процесс совершается без теплообмена с окружающей средой, поэтому для его осуществления систему теплоизолируют или ведут процесс так быстро, чтобы теплообмен не успел произойти. При адиабатическом процессе изменяются все три параметра р, V, Т.
 При адиабатическом сжатии идеального газа температура его повышается, а при расширении понижается. На рисунке 2 в системе координат р (V) изображены изотерма (рV = const) и адиабата (рV γ = const). Из рисунка 2 видно, что адиабата спадает круче изотермы. Объясняется это тем, что при адиабатическом сжатии увеличение давления газа происходит не только из-за уменьшения его объема, как при изотермическом сжатии, но и за счет повышения температуры.
При адиабатическом сжатии идеального газа температура его повышается, а при расширении понижается. На рисунке 2 в системе координат р (V) изображены изотерма (рV = const) и адиабата (рV γ = const). Из рисунка 2 видно, что адиабата спадает круче изотермы. Объясняется это тем, что при адиабатическом сжатии увеличение давления газа происходит не только из-за уменьшения его объема, как при изотермическом сжатии, но и за счет повышения температуры.
Теплоемкостью вещества (тела) называется величина, равная количеству теплоты, необходимому для нагревания его на единицу температуры. Теплоемкость зависит от массы тела, его химического состава и вида теплового процесса. Теплоемкость одного моля вещества называется молярной теплоемкостью С µ.
| Рисунок 2 – Изотерма и адиабата |
 (2)
(2)
Используя первое начало термодинамики (2) и уравнение Клапейрона – Менделеева (1), можно вывести уравнение Пуассона, описывающее адиабатический процесс:
pV γ = const,
или в других параметрах:
TV γ-1 = const,
T γ p 1-γ = const.
В этих уравнениях γ – показатель адиабаты:
 ,
,
где С V и С p – молярные теплоемкости при постоянном объеме и давлении, соответственно.
Для идеального газа расчет теплоемкостей С V и С p можно провести теоретически. При нагревании газа при постоянном объеме (изохорический процесс) работа газа δA = рdV равна нулю, поэтому молярная теплоемкость:
 , (3)
, (3)
где i – число степеней свободы – количество независимых параметров, с помощью которых однозначно можно задать движение молекулы; индекс V означает изохорический процесс.
При изобарном нагревании (p = const) теплота, подводимая к газу, расходуется на увеличение внутренней энергии и на совершение работы расширения газа δ A = pdV = (m/μ) RdT. Теплоемкость моля газа при этом равна
,  (4)
(4)
т.е.
 . (5)
. (5)
Уравнение (5) называется уравнением Майера. Из (4) и (5) видно, что разность молярных теплоемкостей С р – С V = R численно равна работе расширения одного моля идеального газа при нагревании его на один кельвин при постоянном давлении. В этом заключается физический смысл универсальной газовой постоянной R.
Для идеальных газов отношение  зависит только от числа степеней свободы молекул газа, которое, в свою очередь, определяется структурой молекулы, т.е. количеством атомов, из которых состоит молекула. Одноатомная молекула (инертные газы) имеет 3 степени свободы, однозначно определяющие скорость ее поступательного движения. Если молекула состоит из двух атомов, то число степеней свободы складывается из числа степеней свободы поступательного движения (i пост = 3) центра масс и вращательного (i вр = 2) движения системы вокруг двух осей, перпендикулярных к оси молекулы, т.е. равно 5. Для трех- и многоатомных молекул i = 6 (три поступательные и три вращательные степени свободы).
зависит только от числа степеней свободы молекул газа, которое, в свою очередь, определяется структурой молекулы, т.е. количеством атомов, из которых состоит молекула. Одноатомная молекула (инертные газы) имеет 3 степени свободы, однозначно определяющие скорость ее поступательного движения. Если молекула состоит из двух атомов, то число степеней свободы складывается из числа степеней свободы поступательного движения (i пост = 3) центра масс и вращательного (i вр = 2) движения системы вокруг двух осей, перпендикулярных к оси молекулы, т.е. равно 5. Для трех- и многоатомных молекул i = 6 (три поступательные и три вращательные степени свободы).
В данной работе определяется коэффициент γ для воздуха. Если при помощи насоса в сосуд накачать некоторое количество воздуха, то давление и температура воздуха внутри сосуда повысятся. Вследствие теплообмена с окружающей средой через некоторое время температура воздуха, находящегося в сосуде, сравняется с температурой T 0 внешней среды.
Давление, установившееся в сосуде, равно р 1 = р 0 + р ′, где р 0 – атмосферное давление, р ′ – добавочное давление. При этом воздух внутри сосуда характеризуется параметрами (р 0 + р ′), V 0, Т 0, а уравнение состояния имеет вид:
 (6)
(6)
Если на короткое время (~ 3с) открыть тумблер «АТМОСФЕРА», то воздух в сосуде будет расширяться. Этот процесс расширения можно рассматривать как подключение к сосуду дополнительного объема V ′. Давление в сосуде станет равным атмосферному Р 0, температура понизится до Т 1, а объем будет равен V 0 + V ′. Тогда в конце процесса уравнение состояния будет иметь вид:
 . (7)
. (7)
Разделив выражение (7) на выражение (6), получим:
 . (8)
. (8)
Расширение происходит быстро, так что в течение процесса теплообмен с окружающей средой незначителен и им можно пренебречь, т.е. процесс является адиабатическим; поэтому для начального и конечного состояний системы справедливо соотношение:
 . (9)
. (9)
Охладившийся при расширении воздух через некоторое время, вследствие теплообмена с внешней средой, нагреется до комнатной температуры Т 0 (изохорический процесс). Давление возрастет до некоторой величины р 2 = р 0 + р ′′, где р ′′ – новое добавочное давление. Для воздуха массой m ′, оставшегося в сосуде, уравнение состояния в начале нагрева:
 , (10)
, (10)
а в конце нагрева до комнатной температуры Т 0:
 . (11)
. (11)
Разделив (10) на (11), получим:
 . (12)
. (12)
Правые части выражений (8) и (12) одинаковы, следовательно, левые части также равны:
 . (13)
. (13)
Возведя левую и правую часть (13) в степень γ, запишем:
 . (14)
. (14)
Заменим правую часть (14) с учетом (9):
 ;
;
откуда
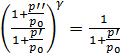 . (15)
. (15)
Поскольку р ′ << р 0; р ′′ << р 0, то, ограничиваясь первым членом разложения в ряд бинома (1+ х)γ=1+γ х и пренебрегая членами второго порядка малости, получим для показателя адиабаты γ:
 ;
;
 ;
;
 . (16)
. (16)




