Химия – наука о веществах, их свойствах, строении и взаимных превращениях.
Предмет химии – химические элементы и их соединения, а также закономерности, которым подчиняются химические реакции.
Вещество – это совокупность атомно-молекулярных частиц, нахо-дящихся в одном из нескольких агрегатных состояний; или то, из чего состоят все тела; или форма движущейся материи, обладающая массой покоя. Все химические вещества способны подвергаться различным изменениям, которые относятся к физическим или химическим явлениям. Физическими называются явления, при которых изменяется форма или физическое состояние вещества, а состав не изменяется. К химическим относятся явления, в результате которых одно вещество превращается в другое. Их также называют химическими реакциями или химическими превращениями.
Атом – мельчайшая частица вещества, являющаяся пределом его химического разложения. Атом - это электронейтральная система, состоящая из положительно заряженного ядра и движущихся в его поле отрицательно заряженных элементарных частиц - электронов. В состав ядра входят другие субатомные элементарные частицы: протоны, имеющие положительный заряд, и нейтроны. Атомы одного сорта характеризуют химический элемент. Поскольку атом электронейтрален, то число протонов в нем равно числу электронов, так как заряды этих частиц равны по величине, но противоположны по знаку.
Химический элемент - это совокупность атомов с одинаковым зарядом ядра или порядковым номером химического элемента в Периодической системе химических элементов Д. И.Менделеева. Заряд ядра атома (число протонов в нем) равен порядковому номеру его химического элемента в периодической системе. Химический элемент обозначается международным символом с помощью букв латинского алфавита.
Молекула – это наименьшая частица вещества, обладающая его химическими свойствами. В молекулу могут входить атомы одного или нескольких элементов. Вещество, образованное атомами одного химического элемента, относится к простому веществу (инертные газы, кислород, азот, галогены, водород, углерод, кремний, металлы и др.). Сложное вещество образовано атомами разных химических элементов (оксиды, кислоты, соли, основания, пероксиды и т.д.). Вещество может состоять не только из атомов (He, O2, P4, Hg) и молекул (CO2, H2O, HNO3, NH3, H2S, C6H12O6), но и ионов. Ионное строение имеют все соли (CuSO4, NaCl и др.), основания (NaOH, Mg(OH)2, и др.).
Ионы – это заряженные частицы, образованные в процессе отдачи или присоединения электронов нейтральными атомами. Катионы – положительно заряженные частицы (Fe3+, K+, Ca2+); анионы – отрицательно заряженные частицы (Cl-, H-, S2-).
Так как абсолютные массы атомов малы (1.10-24 – 1.10-22 г), то на практике используются относительные атомные массы Аr, т.е. некоторые соотношения между абсолютными массами различных атомов. Относительная атомная масса элемента - это число, показывающее, во сколько раз масса одного атома данного элемента больше 1/12 части массы атома изотопа углерода 12 (12С). За основу единой шкалы относительных атомных масс был выбран изотоп углерода-12, для которого значение относительной атомной массы установлено равным 12,0. По современной шкале атомной единицей массы (а.е.м.) является унифицированная углеродная единица 1,66057.10-24 г. Значения относительных атомных масс элементов определяют как частное от деления значения абсолютной массы атома данного элемента к 1/12 части абсолютной массы атома изотопа 12С. Масса атома определяется массой ядра. Сумма протонов и нейтронов задает массовое число, которое указывается индексом в верхнем левом углу. Нижний индекс указывает на порядковый номер или заряд ядра ( ). Протон – положительно заряженная частица (
). Протон – положительно заряженная частица ( ), относительная масса которой равна 1,007277 а.е.м или приближенно 1 а.е.м., а заряд равен +1. Нейтрон – электронейтральная частица (
), относительная масса которой равна 1,007277 а.е.м или приближенно 1 а.е.м., а заряд равен +1. Нейтрон – электронейтральная частица ( ), относительная масса которой равна 1,008665 а.е.м. или приближенно 1 а.е.м., а заряд равен 0. Электрон – отрицательно заряженная частица (
), относительная масса которой равна 1,008665 а.е.м. или приближенно 1 а.е.м., а заряд равен 0. Электрон – отрицательно заряженная частица ( ), масса которой равна 0,0005468 а.е.м. или приближенно равна нулю, а заряд -1. Изотопами называются разновидности атомов одного и того же элемента, которые имеют разные массовые числа. Например, изотопы водорода
), масса которой равна 0,0005468 а.е.м. или приближенно равна нулю, а заряд -1. Изотопами называются разновидности атомов одного и того же элемента, которые имеют разные массовые числа. Например, изотопы водорода  - протий,
- протий, 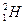 - дейтерий,
- дейтерий,  - тритий. Атомная масса элемента в Периодической системе – это средняя величина массовых чисел всех его природных изотопов с учетом их процентного содержания. Например, атомы хлора в природе распространены в виде двух изотопов: 35Cl (75,5%) и 37Cl (24,5%). Средняя атомная масса атома хлора определяется как Аr(Cl) = 35×0,755 + 37×0,245 = 35,5 а.е.м.
- тритий. Атомная масса элемента в Периодической системе – это средняя величина массовых чисел всех его природных изотопов с учетом их процентного содержания. Например, атомы хлора в природе распространены в виде двух изотопов: 35Cl (75,5%) и 37Cl (24,5%). Средняя атомная масса атома хлора определяется как Аr(Cl) = 35×0,755 + 37×0,245 = 35,5 а.е.м.
Относительной молекулярной массой вещества Мr называется отношение массы молекулы вещества к 1/12 массы атома 12С. Мr хими-ческого соединения – число, показывающее, во сколько раз абсолютная масса одной молекулы этого соединения больше а.е.м. Мr – это сумма Аr эле-ментов, входящих в молекулу с учетом его химической формулы. Нельзя говорить об относительной молекулярной массе соединений ионного состава, а следует находить для них формульную массу. Аr и Мr являются мерой масс атомов и молекул и позволяют сделать вывод о соотношении масс атомов в молекуле.
Химическая формула – это условная запись состава вещества посредством химических символов, числовых и буквенных обозначений. Она указывает на состав индивидуального вещества. По химической формуле проводят расчеты молекулярной массы соединения: Мr (H2SO4) = 2×Аr(H) + Аr(S) + 4×Аr(O) = 2×1 + 32 + 4×16 = 98 а.е.м.
Химическое уравнение реакции – это условная запись химической реакции посредством химических знаков и формул: СаСО3 + 2НСl = CaCl2 + CO2 + H2O. С химическими уравнениями можно проводить алгебраические действия: складывать, вычитать одно уравнение из другого или делить все члены уравнения на одинаковое число, а также переносить члены из одной части уравнения в другую, изменяя при этом знаки. При написании химических реакций в левой части уравнения записывают формулы веществ, вступающих в реакции, которые называют исходными или реагентами (СаСО3 и НСl). Образующиеся в правой части вещества называются продуктами реакции (CaCl2, CO2 и H2O).
Количество вещества (n). Для того, чтобы легче различать микро- и макрообласти химии, введено понятие о количестве вещества n, которое определяется числом структурных частиц (атомов, молекул или других частиц) этого вещества и выражается в молях (моль, в системе CИ). Количество вещества, содержащееся в порции простого или сложного вещества, определяется сравнением с некоторым строго определенным единичным количеством вещества. Основой сравнения служит изотоп 12С.
Моль – это количество вещества, содержащее столько же формульных единиц этого вещества, сколько имеется атомов в 12 г (точно) изотопа углерода –12.
Формульная единица вещества - (структурный элемент) – это химическая частица (атом, молекула, катион, анион), а также любая совокупность химических частиц, передаваемая ее химической формулой: Na; H2O; NH4+; CO32-; (NH4)2CO3; NH3.H2O.
Число формульных единиц, содержащихся в одном моле любого вещества, называется числом Авогадро - NA= 6,02.1023. Для нахождения количества вещества (n) можно использовать следующие формулы:
n = V/VМ; n = m/M; n = N/NA.
Молярная масса
Химические вещества реагируют между собой в количествах, пропорциональных стехиометрическим коэффициентам в уравнении реак-ции. Для количественного описания реакций целесообразнее использовать количество вещества, а не его массу или объем (хотя и удобнее). Для удобства расчетов, проводимых на основании химических реакций и учитывающих количества исходных реагентов и продуктов взаимодействия в молях, вводится молярная масса вещества.
Молярная масса вещества - отношение массы некоторой порции этого вещества к количеству вещества в этой порции М=m/n. Единицей молярной массы в системе СИ является кг/моль, а в практике – г/моль. М – постоянная величина для каждого данного вещества. Значение молярной массы численно совпадает с относительной молекулярной массой данного элемента (для одноатомного простого вещества). Например: для Na - Ar (Na) = 23 а.е.м.; М(Na) = 23 г/моль; для O – (А)r = 16 а.е.м., М(О) = 16 г/моль; для О2 – Мr (О2)
= 32 а.е.м., М(О2)= 32 г/моль.
В природе индивидуальные вещества в чистом виде практически не встречаются, а приходится иметь дело со смесями. В любом используемом на практике веществе всегда присутствует незначительное количество примеси. Количественное содержание вещества в смеси определяется долями, чаще всего выражаемыми в процентах, а можно и в виде дробного числа.
Массовая доля (w) вещества в смеси равна отношению массы данного вещества к сумме масс всех веществ, входящих в состав смеси:

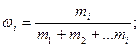

 %
%
Мольная доля (c) вещества в смеси равна отношению количества данного вещества к сумме количеств всех веществ, входящих в состав смеси:



 %
%
Объемная доля (j) вещества в смеси равна отношению объема, занимаемого данным веществом, к сумме объемов всех веществ, входящих в состав смеси:

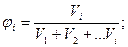

 %
%
Средняя молярная масса смеси определяется по формуле:
 .
.
Закон сохранения массы. В изолированной системе масса продуктов реакции равна массе исходных веществ. Изолированная система – система, не обменивающаяся с внешней средой ни массой, ни энергией. Если система открыта, то закон нарушается. Однако он может быть скорректирован соотношением Эйнштейна Е=mc2. Е и m – эквивалентные значения энергии и массы. С – скорость света в пустоте, равная 2,997925×105 м/с. Это означает, что никакой химический процесс не осуществляется без изменения массы вещества. Так, при сгорании 1 моль Н2 в кислороде с образованием водяного пара выделяется и рассеивается в окружающей среде 241 835 Дж энергии. С этой энергией по приведенному уравнению рассеивается масса вещества, равная 2,69×10-12 кг, которую обнаружить современными методами взвешивания невозможно. Это обстоятельство и послужило основой формулировки закона сохранения массы веществ. Объяснение в том, что при течении химической реакции происходит только перегруппировка атомов, а число атомов каждого элемента и их масса остаются постоянными. Поэтому для химических реакций можно считать, что закон выполняется всегда. Коэффициенты в уравнении реакции позволяют уравнивать число атомов в левой и правой его частях. Химические реакции классифицируют по:
- изменению числа исходных веществ и продуктов реакции (реакции соединения, в результате которых из простых веществ образуются сложные С+О2=СО2 или из нескольких простых веществ образуется более сложное вещество СаО+2СО2+Н2О=Са(НСО3)2; реакции обмена – образование из одних сложных веществ других в результате обмена их составными частями 2NaOH+ H2SO4=Na2SO4+2H2O; реакции замещения, в результате которой атомы простого вещества замещают атомы одного из элементов сложного Fe+CuSO4=FeSO4+Cu; реакции разложения, протекающие с образованием нескольких простых или сложных веществ из одного сложного 2Ag2O®4Ag+O2; 2Al(OH)3®Al2O3+3H2O).
- выделению или поглощению теплоты, которые называют термохимическими (экзотермические, протекающие с выделением теплоты, и эндотермические – с поглощением теплоты);
- обратимости делятся на обратимые и необратимые (необратимые реакции протекают до конца, т.е. до полного превращения в продукты реакции СаСО3®СаО+СО2; обратимые реакции протекают одновременно в двух взаимопротивоположных направлениях N2+3H2  «2NH3);
«2NH3);
- агрегатному состоянию взаимодействующих и образующихся веществ реакции делятся на гомогенные и гетерогенные (гомогенные реакции протекают между веществами, находящимися в одинаковом агрегатном состоянии СН4(г)+2О2(г)=СО2(г)+2Н2О(г); гетерогенные реакции протекают между веществами, находящимися в различных агрегатных состояниях С(тв)+о2(г)=СО2(г));
- изменению степени окисления атомов, входящих в состав реагирующих веществ (окислительно-восстановительные реакции).
Закон постоянства состава. Состав сложного вещества не зависит от способа его получения. Оказалось, что закон имеет ограниченное примене-ние. Он всегда выполняется для газов, тогда как для жидкого и твердого агрегатных состояний – только в случае веществ с молекулярным строением. Кристаллические вещества атомного и ионного строения обычно имеют нестехиометрический состав, что обеспечивается образованием дефектов - катионных или анионных вакансий. Например: Na1,0000001-1,001Cl (анионная вакансия занята электроном); Fe0,89-0,06О (катионная вакансия компенси-руется повышением заряда у двух ионов железа от +2 до +3); V2Ta0,9-1,17 (нейтральные вакансии). Область гомогенности - область составов, в которой существует данное химическое соединение. Если у нестехио-метрического соединения стехиометрический состав попадает в область гомогенности, то соединение относят к дальтонидам (NaCl; V2Ta), если нет, то к бертолидам (FeO, NiO). В случае жидких или твердых растворов закон не выполняется.
Закон кратных отношений. Если два элемента образуют между собой несколько соединений, то массы одного из них, приходящиеся на одну и ту же массу второго, относятся как небольшие целые числа. Например: N2O, N2O3 и N2O5 (на 28 г азота приходится 16:48:80 = 1:3:5) или СО и СО2 (на 12 г углерода приходится кислорода 16:32=1:2). Эти числа соответствуют либо степени окисления, либо половинам степеней окисления элемента с постоянной массой. Естественно, что закон выполним для газов и веществ с молекулярным строением в любом агрегатном состоянии.
Закон объемных отношений. Объемы участвующих в реакции газов относятся как небольшие целые числа. Эти числа пропорциональны коэффициентам в уравнении реакции. Например: 4NH3+5O2=4NO + 6H2O
(n(NH3):n(O2):n(NO):n(H2O)=V(NH3):V(O2):V(NO):V(H2O) = 4: 5: 4: 6).
Закон Авогадро. В равных объемах различных газов при одинаковых условиях (р и Т) содержится одинаковое число структурных единиц (молекул, атомов).
Следствия из закона
Одинаковое число молекул различных газов при равных условиях занимает одинаковый объем.
Один моль любого газа при одинаковых условиях занимает одина-ковый объем, который называется молярным объемом (VМ) [n=V/VМ]. При нормальных условиях VМ=22,4 л. Нормальные условия (н.у.): ро=101,3 кПа; То=273 К.
Относительная плотность одного газа (Х) по другому (А) равна отношению их молярных масс: DХА= rх/rА=МХ/МА (краткая запись DА).
Мольные и объемные доли для газов одинаковы: j= V1/V2+V1; c=n1/n1+n2; j=c.
Для газовой смеси выполняются закон Авогадро и первые три следствия. Для нее можно использовать понятие о средней молярной массе:
Мср. = åМici=åМiji= М1f1+М2f2+…Мifi.
Закон Авогадро и его следствия выполняются для идеальных газов, в которых отсутствуют межмолекулярные взаимодействия и молекулы не имеют собственного объема. Идеальные газы, а также их смеси описываются с помощью трех параметров: давление (р), объем (V), температура (Т). Для них выполняются: закон Бойля-Мариотта - р1×V1=р2×V2 (T=const); закон Гей-Люссака - Т1×V2=T2×V1 (p=const); закон Шарля – Т1×р2=Т2×р1 (V=const); объединенный газовый закон - р1V1/T1 = р2V2/T2. Если использовать в этом законе параметры нормальных условий для 1 моля газа (VМ=22,4 л/моль), то можно получить универсальную газовую постоянную: R=0,082 л×атм./моль×К (р=1 атм.); 8,314 кПа×л/моль×К (р=101,3 кПа); 62,36 мм.рт.ст.×л/моль×К (р =
760 мм.рт.ст.). Подставляя R в выражение объединенного газового закона, получаем уравнение состояния идеального газа для n=1 моль. Если n моль, то – уравнение Менделеева-Клапейрона: рV = nRT или рV =  .
. 
Закон Дальтона. Общее давление смеси газов равно сумме парциаль-ных давлений компонентов (Р=р1+р2+…+рi). Парциальное давление (р) – это давление, которое производил бы компонент газовой смеси, если бы он занимал объем, равный объему смеси (рi =ji.Р).
Закон Дюлонга и Пти (закон удельных теплоемкостей). Атомные теплоемкости простых веществ одинаковы и приблизительно равны 26 Дж/моль×К (или 6,3-6,4 кал/моль). Атомная теплоемкость (СМ) – количество тепла, необходимое для нагревания 1 моль вещества на 1 оС. Удельная теплоемкость (Сm) – количество тепла, необходимое для нагревания 1 г вещества на 1оС
М= Аr= CМ/Cm=26/Cm (г/моль).
Закон Гесса (закон постоянства количества теплоты).
Тепловой эффект процесса зависит от начального и конечного состояния системы и не зависит от пути перехода между ними.
Закон эквивалентов. Количество эквивалентов всех участвующих в реакции веществ одинаково (m1/Mэ(1) = m2/Mэ(2) =nэкв.) или: массы (m) реагирующих веществ пропорциональны их эквивалентам (Э), т.е. для реакции А + 2B = AB2 закон эквивалентов представляется в виде соотношения: m(A): m(B): m(AB2) = Э(А): Э(В): Э(АВ2).
Эквивалент (Э) - реальная или условная частица, равноценная в реак-циях одному атому или иону водорода. Химический эквивалент элемента – это такое его количество, которое соединяется с одним молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Молярная масса эквивалента (Мэ) – масса числа Авогадро эквива-лентов, выраженная в граммах (г/моль). Молярная масса эквивалента (Мэ):
- элемента в соединении равна молярной массе элемента, деленной на
степень его окисления;
- иона равна отношению молярной массы иона к его заряду по модулю;
- сложного вещества равна сумме молярных масс эквивалентов
реальных или формальных ионов, составляющих молекулу.
Кроме того, для сложных веществ молярную массу эквивалента (Мэ) можно определить,используя формулы:
а) оксида М2Оn - Мэ = М(М2Оn)/2n;
б) основания М(ОН)n - Мэ = М(М(ОН)n)/n;
г) кислоты НnMOm - Mэ = M(HnMOm)/n,
(где n – основность, т.е. число протонов, способных диссоциировать);
д) соли MnAm - Мэ= М(МnAm)/n×m (где n – число катионов; m – заряд катиона по модулю или m – число анионов; n – заряд аниона по модулю. Произведение n×m – это не произведение числа катионов на число анионов). Например: Na2SO4 – Мэ=М/2; Al2(SO4)3 – Мэ=М/6; CaSO4 – Мэ=М/2; Bi2O3 – Мэ=М/6; Mg(OH)2 – Мэ=М/2; H4SiO4 – Мэ=М/4; H3PO3 – Мэ=М/2 (кислота двухосновная Н2[HPO3]); H4C2O2 – Мэ=М/1 (CH3COOH). Необходимо учитывать, что в реакциях многоосновные кислоты и многокислотные основания могут вести себя как одноосновные и однокислотные. Например, в реакции H2SO4 + NaOH = NaHSO4 + H2O для серной кислоты Мэ=М; а в реакции H2SO4+2NaOH = Na2SO4 + 2H2O для серной кислоты Мэ= М/2.
В реакциях окисления-восстановления Мэ равно отношению М к числу обменивающихся электронов:
2KMnO4 + 16HCl = 5Cl2 + 2MnCL2 +2KCL + 8H2O;
Mn+7 + 5e ® Mn+2 Мэ(KMnO4) = M/5.






