Аннотация
Изучив представленный материал, студент будет знать номенклатуру, способы получения алканов, их физические и химические свойства. Основные процессы переработки алканов: хлорирование, дегидрирование, крекинг, каталитическое окисление. Получение формальдегида и синтетических жирных кислот.
предельные углеводороды (алканы, парафины)
Предельными (насыщенными) углеводородами называют такие соединения углерода с водородом, в молекулах которых каждый атом углерода затрачиваёт на соединение с любым соседним углеродным атомом не более одной валентности, причем все свободные (не затраченные на соединение; с углеродными атомами) его валентности насыщены водородом. Все атомы углерода находятся в sp3-гибридном состоянии.
Предельные углеводороды образуют гомологический ряд с общей формулой СnН2n+2.Родоначальником этого ряда является метан.
Предельные углеводороды с n=1, 2 и 3 могут существовать только в виде одного изомера.
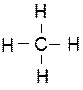
| 
| 
|
| метан (n=1) | этан (n=2) | пропан (n=3) |
Начиная с четвертого члена гомологического ряда, возможна структурная изомерия. Углеводород с n =4 (бутан) существует в виде двух, углеводород с n = 5 — в виде трех, углеводород n = 6 — в виде пяти структурных изомеров. Число изомеров парафинов в зависимости от количества атомов углерода приведено в табл. 1.
.
Таблица – 1 Зависимость числа изомеров предельных углеводородов от длины цепи
| Число атомов в цепи углерода | Число изомеров | Число атомов в цепи углерода | Число изомеров |
Изомерия бутанов была установлена А. М. Бутлеровым. Изомерные пентаны были получены его учеником М. Д. Львовым. Синтез всех изомерных гептанов был завершен к 1929 г. изомерных октанов — к 1946 г. Для высших гомологов получено в чистом виде по нескольку изомеров. Известен, например, углеводород н-гектан С100Н202 с т. пл. 115 0С.
Многообразие структурных изомеров требует четкости в их наименовании — номенклатуре. В органической химии используются эмпирическая (тривиальная), рациональная и систематическая номенклатуры.
Тривиальная номенклатура — это случайные названия органических соединений, обычно указывающие или на их природный источник, или на какое-либо их свойство, обратившее на себя в первую очередь внимание химика, впервые получившего это соединение. В настоящее время так называют только наиболее часто используемые соединения, например ацетон, уксусная кислота и т. д
В органической химии долгое время применялась номенклатура, основным принципом которой было обозначение всех изомеров и гомологов как производных родоначальника ряда в случае предельных углеводородов - метана. В настоящее время эта номенклатура под названием «рациональной» применяется только в тех случаях, когда она дает особенно наглядное представление о соединении.
Основные правила систематической номенклатуры были приняты в 1892 г. на съезде химиков в Женеве. На последующих съездах в эту номенклатуру были внесены изменения и дополнения. Последние принципиальные изменения и дополнения были приняты на съездах химиков в 1957 г, и в 1965 г. и эта номенклатура получила название номенклатура ИЮПАК.
В соответствии с правилами номенклатуры первые четыре предельных углеводорода с нормальной цепью (без разветвлений), когда каждый атом углерода связан непосредственно не более чем с двумя другими атомами углерода, имеют эмпирические названия: метан СН4, этан C2H6, пропан C3H8, бутан С4Н10. Далее названия углеводородов образуются из греческих и латинских числительных добавлений суффикса -ан- пентан С5Н12, гексан С6Н14, гептан С7Н16, октан С8H18, нонан С9H20, декан С10Н22, ундекан С11Н24, додекан C12H26 и т. д.
Для правильного формирования названия изомеров с разветвленной цепью, необходимо знать наименования простейших одновалентных органических радикалов, т.е. остатков, образующихся в результате отрыва атомов водорода от предельных углеводородов. Одновалентные радикалы называют, заменяя суффикс -ан предельных углеводородов на -ил, например: алканы — алкилы, метан - метил СН3—, этан — этил СН3—СН2—, пропан — пропил СН3—СН2—СН2—, бутан - бутил СH3—СН2—СН2-СН2-, пентан — пентил (амил) и т. д.
Важно отметить, что если свободная валентность в радикале принадлежит атому углерода, не имеющему или имеющему только одну непосредственную связь с углеродными атомами, то радикал называется первичным. При наличии двух таких связей радикал называется вторичным, трех третичным. Понятия первичный, вторичный, третичный и четвертичный в органической химии относятся к углеродным атомам. Так, например, 2-метилпентан имеет три первичных, два вторичных и один третичный углеродный атом.
Пропана может быть представлен двумя радикалами (пропил и изопропил), от бутан — четырьмя радикалами:
 изопропил
изопропил
|  вторичный бутил
вторичный бутил
|
 изобутил
изобутил
| 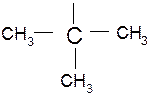 третичный бутил
третичный бутил
|
В соединении выбирается самая длинная углеродная цепь, затем нумеруется, начиная с того конца, к которому ближе радикал-заместитель. В названии вещества цифрой показывают место радикала-заместителя, словами количество и называют заместитель(ли), а затем называют углеводород, которому отвечает главная цепь. Ниже приведены названия некоторых углеводородов по систематической, рациональной и эмпирической номенклатурам. Бутаны:

| 
|
| н-бутан | 2-метилэтилпропан |
Пентаны:
| 
|
| н-пентан | 2-метилбутан, изопентан |
Радикалы с разветвленной структурой можно называть как замещенные радикалы с нормальной структурой, например:


2,3-диметилбутил 2,3-диметилпропил
(неопентил)

2,2-диметилбутил
Способы получения
Способы получения предельных углеводородов можно условно разделить на промышленные и лабораторные.
1. В промышленности предельные углеводороды с небольшим числом углеродных атомов (до 11 включительно) получают:
- фракционной перегонкой природного газа или бензиновой фракции нефти, или смесей углеводородов получаемых гидрированием угля;
- гидрированием оксида и диоксида углерода.
2. В лабораторных условиях предельные углеводороды, начиная с пентана, наиболее часто получают каталитическим гидрированием этиленовых или более непредельных углеводородов с тем же числом углеродных атомов и таким же строением цепи:
RCH=CH2+H2  RCH2CH3
RCH2CH3
Непредельные углеводороды с заданным строением углеродной цепи легче получать, чем предельные.
3. Предельные углеводороды получают восстановлением галогенопроизводных каталитически возбужденным водородом, водородом в момент выделения или с помощью восстановителей, каким, например, является йодистый водород:
C2H5Cl + H2 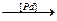 C2H6 + HCl
C2H6 + HCl
Хлористый этил
C2H5Cl + 2H  C2H6 + HCl
C2H6 + HCl
C2H5I + H I  C2H6 + I2
C2H6 + I2
4. Предельные углеводороды получают из соединений с меньшим числом углеродных атомов осуществляется действием натрия на галогенопроизводные — реакция Вюрца:
2C2H5l+2Na ®С2Н5 — C2H5 + 2NaI.
Особенностью синтеза Вюрца является то, что в случае использования в качестве исходных веществ различных галогеналкилов в результате реакции получается смесь трех углеводородов:

Однако эту смесь приходится разделять, что не всегда возможно. Поэтому смеси двух различных галогенилкилов вводятся в реакцию Вюрца редко.
5. К другим методом получения предельных углеводородов относится также электролиз солей карболовых кислот: анионы кислот распадаются на аноде с образованием свободных радикалов, которые объединяются в молекулы более сложных предельных углеводородов — реакция Кольбе:
R—COONa«R—СОО- + Na+
R—COO- ® R—COO·
R—СО—О· ®R·+ СO2 2R·®R—R
Физические свойства
У предельных углеводородов физические свойства определяются их составом и строением.
В гомологическом ряду углеводородов с линейной (нормальной) цепью четыре первых члена при обычной температуре — газы, далее следуют жидкости и, начиная с С16Н34— твердые вещества.
С ростом длины цепи температуры кипения в гомологическом ряду возрастают, причем разность температур кипения ближайших гомологов все это время уменьшается. Изомеры с нормальной цепью углеродных атомов кипят при более высокой температуре, чем углеводороды с разветвленной цепью. Это объясняется меньшим взаимодействием между молекулами с разветвленной цепью в жидком состоянии: ответвления от главной цепи создают пространственные препятствия для сближения молекул. Важно отметить, что углеводороды с разветвленной цепью имеют меньшую склонность к комплексообразованию, например, с мочевиной. Поэтому нормальные углеводороды можно отделять от изомеров с разветвленной структурой в виде комплексов с мочевиной (промышленный метод).
Помимо адсорбционного метода выделения линейных парафинов из нефтяных фракций в промышленности в последнее время все большее значение приобретают методы разделения смесей с помощью клатратов — соединений включения. Эти методы основаны на различной способности молекул, отличавшихся по форме и величине, размещаться между молекулами некоторых твердых веществ, имеющих слоистую или сетчатую кристаллическую структуру. Извлеченные в виде клатратов вещества достаточно легко освобождаются от «хозяина». В нефтеперерабатывающей промышленности наиболее широко используются в качестве клатратообразователей мочевина, тномочевина, некоторые комплексные соли металлов, цеолиты и другие материалы.
Таблица – 2 Физические свойства парафинов
| Углеводород | Т. пл.., оС | Т. кип., оС | Плотность, d420 | Показатель преломления, nD20 |
| Метан СН4 | -182,5 | -161,6 | 0,4161 | - |
| Этан С2Н6 | -182,8 | -88,6 | 0,5461 | - |
| Пропан С3Н8 | -187,6 | -42,1 | 0,5082 | |
| Бутан С4Н10 | -138,3 | -0,5 | 0.5842 | 1.3326 |
| Изобутан СН3СН(СН3)СН3 | -159,4 | -11,7 | 0.5632 | - |
| н-ПентанС5Н12 | -129,8 | 36,07 | 0,563 | 1,3575 |
| Изопентан (СН3)2СНСН2СН3 | -159,9 | 27,9 | 0,626 | 1,3537 |
| Неопентан СН3С(СН3)3 | -16,6 | 9,5 | 0,613 | 1,3513 |
| н-Гексан С6Н14 | -95,3 | 68,7 | 0,660 | 1,3749 |
| Неогексан (CH3)3CCH2СH3 | -99,7 | 49,7 | 0,649 | 1,3876 |
| н-Гептан C7H16 | -90,6 | 98,5 | 0,684 | 1,3838 |
| н-Октан С8Н18 | -56,8 | 125,7 | 0,703 | 1,3974 |
| Изооктан (СН3)3ССН2СН(СН3)2 (2,2,4-триметилпентан) | -107,4 | 99,2 | 0,692 | 1,3915 |
| н-Нонан С9Н20 | -53,6 | 150,8 | 0,718 | 1,4056 |
| н-Декан C10H22 | -29,7 | 174,0 | 0,730 | 1,4120 |
| н-Пентадекан С15Н32 | 10,0 | 270,5 | 0,765 | 1,4313 |
| н-ЭйкозанС20Н42 | 36,4 | 205,0 (2кПа) | 0,777 (при т. пл.) | - |
| н-ГектанС100Н202 | 115,2 | - | - | - |
1- При температуре кипения
2- В жидком состоянии под давлением
В гомологическом ряду предельных углеводородов температуры плавления медленно возрастают. При этом предельные углеводороды образуют два ряда: четных и нечетных гомологов. Температуры плавления четных гомологов обычно выше, чем у нечетных. В ряде случаев изомеры с разветвленной структурой имеют более высокие температуры плавления. Первым твердым углеводородом (т. пл. 104оС) является один из изооктанов гексаметилэтан (2,2,3,3-тетра-метилбутан).
Плотность предельных углеводородов вначале быстро, затем медленно возрастает до 0,78. Предельные углеводороды — вещества неполярные и трудно поляризуемые. Растворимость их в воде ничтожна.
В молекулах предельных углеводородов атомы соединены только s-связями. Расстояния между соседними углеродными атомами 0,154 нм. В коротких цепях по С—С-связям возможно свободное или почти свободное вращение.
В ИК- спектрах алканов характерны полосы в области 2800—3000см-1 (валентные колебания связи С—Н) 1380—1470см-1 (деформационные колебания той же связи). Полосы поглощения, отвечающие колебаниям связи С—С, мало интенсивны и трудно идентифицируются;
ЯМР-спектры алканов трудно расшифровываются, так как химические сдвиги различным образом расположенных протонов имеют близкие значения (около 0,5—2 м. д.).
Химические свойства
У предельных углеводородов химические превращения могут происходить либо в результате гемолитического разрыва цепи углеродных атомов, либо за счет отрыва атомов водорода (также обычно гемолитического) с последующим замещением их другими атомами или группами. Поэтому для предельных углеводородов характерны реакции расщепления и замещения.
Разрыв цепи по s-связи С—С требует меньшей энергии, так как эта связь менее прочная (350 кДж/моль), чем s-связь С—Н (420 кДж/моль), но химические реакции идут чаще с расщеплением связей С—Н, так как эти связи доступнее действию реагентов.
Процессы разрыва связей С—С или С—Н с образованием свободных радикалов (см. ниже) требуют большой энергии активации и потому при обычной температуре идут только в присутствии катализаторов. При обычной температуре предельные углеводороды не реагируют с концентрированными кислотами, сильными окислителями.
Место вступления заместителя в молекулу предельного углеводорода определяется в первую очередь вероятностью образования и стабильностью образующегося радикала. Радикалы со свободным электроном у третичного атома углерода более стабильны благодаря сверхсопряжению и потому легче образуются. В соответствии с этим реакции замещения в большинстве случаев идут избирательно, наиболее легко у третичного углеродного атома.
Ниже показаны различия в прочности связей С—Н первичного, вторичного и третичного атомов углерода (табл. 3).
Таблица – 3 Энергии связи С – Н
| Соединение | СН3–Н | СН3СН2–Н | (СН3)2СН–Н | (СН3)3С–Н |
| Энергия связи при 0 К, кДж/моль | 422,9 | 401,9 | 393,6 | 339,6 |
Реакции замещения могут протекать по ионному или радикальному механизму. Их условно обозначают буквой S.
А: В + С -® А-: + В:С (SN) нуклеофильное замещение
А: В + С+® А+ + В:С (SЕ) электрофильное замещение
А: В + С• ® А• + В:С (SR) радикальное замещение
Реакции предельных углеводородов обычно идут по механизму SR.
Примеры таких реакций будут рассмотрены ниже.
1. Галогенирование. Одна из наиболее характерных реакций предельных углеводородов — замещение водородных атомов галогенами. Предельные углеводороды вступают в реакцию со всеми галогенами. Со свободным фтором реакция идет со взрывом. Возможны взрывы и в реакциях с хлором. Скорость галогенирования резко снижается в ряду: F > CI > Вг> I. Наибольшее практическое значение имеют фторирование и хлорирование.
Непосредственное взаимодействие углеводородов с фтором дает углерод и фтористый водород; свободный фтор вызывает крекинг углеводородной цепи, так как эта реакция сильно экзотермична табл. 4.
Таблица – 4 Энергетическийбаланс стадий фторирования алканов
| DН, кДж/моль | |
| Разрывы молекулы фтора на атомы требует затраты | 158,8 |
| Разрыв связи С—Н требует затраты около | 427,4 |
| Образование связи C—F дает выигрыш энергии | -452,2 |
| Образование молекулы Н—F дает выигрыш энергии | -569,4 |
Таким образом, реакция идет с выделением теплоты 435,7 кДж/моль, а для разрыва связи С—С требуется всего 350 кДж/моль.
Разбавление фтора азотом или применение растворителей (полностью фторированные углеводороды) позволяют осуществить реакцию, непосредственного фторирования с высокими выходами полифторпроизводных — ценных химически стойких веществ:
CH4+ 4F2 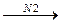 CF4 + 4HF.
CF4 + 4HF.
Хлор реагирует с предельными углеводородам только под влиянием света, при нагревании (300оС) или в присутствии катализаторов, причем последовательно замещаются хлором все атомы водорода:
СН4 +Cl2®CH3Cl3 +HCl (хлористый метил)
CH3Cl +Cl2 ®CH2Cl2 +HCl (хлористый метилен)
CH2Cl2 +Cl2 ® CHCl3 +HCl (хлороформ)
CHCl3 +Cl2® CCl4+HCl (тетрахлорид углерода)
В процессе хлорирования наиболее легко замещается водород наименее гидрогенизированного (третичного) атома углерода. Соотношение между скоростями замещения (при 300оС) водородных атомов при первичном, вторичном и третичном атомах углерода 1: 3,25: 4,3.
В процессе термического хлорирования образуются все возможные изомеры моно- и полигалогенопроизводных.. Однако существует оптимальная температура, при которой моногалогенопроизводные получаются с наибольшим выходом. Для получения монохлорпроизводных необходимо брать большой избыток углеводородов.
Был установлен цепной радикальный механизм реакции. Так, например, для хлорирования метана Н. И. Семеновым и другими предложен следующий механизм (SR):
| DН, кДж/моль | ||
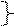 Cl2 ®2Cl• Cl2 ®2Cl•
| зарождение цепи | 242,8 |
 CH•3-H+Cl•®CH3+HCl CH•3-H+Cl•®CH3+HCl
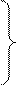 CH•3+Cl2 ®CH3Cl+Cl• CH•3+Cl2 ®CH3Cl+Cl•
| рост цепи | 4,2 |
| -108,9 | ||
| CH 3+CH 3 ®CH3 - CH3 CH•3+Cl•®CH3-Cl Cl + Cl ®Cl2 | обрыв цепи | -370,5 |
| -368,4 | ||
| -242,8 |
Такая диссоциация может быть вызвана при обычной температуре фиолетовым светом, поглощение которого молекулой придает ей энергию порядка 293,0 кДж/моль. Для термической диссоциации молекулы хлора на атомы необходима температура около 300оС. Диссоциация молекулы хлора на ионы требует затраты около 1130,2 кДж/моль.
Процесс хлорирования в присутствии катализаторов, например, хлоридов некоторых металлов, может иметь цепной ионный механизм:
2. Сульфохлорирование и сульфоокисление. С ерная кислота при обычной температуре на алканы не действует. При нагревании она действует как окислитель. Однако дымящая серная кислота с высшими парафинами дает сульфокислоты:
R-H+H2SO4  R-SO3H+H2О
R-SO3H+H2О
Небольшое практическое значение приобрел другой способ превращения парафинов в сульфокислоты и их производные — реакции сульфохлорирования и сульфоокисления, протекающие по следующим общим уравнениям:
R-H+SO2+Cl2  R-SO2-Cl+HCl (сульфохлорирование)
R-SO2-Cl+HCl (сульфохлорирование)
алкансульфохлорид
R-H+2SO2+О2+H2O  R-SO2ОН+H2SO4 (сульфоокисление)
R-SO2ОН+H2SO4 (сульфоокисление)
алкансульфокислоты
Практически все углеводороды, начиная с метана, вступают в реакцию фотохимического сульфохлорирования при комнатной температуре. Атомы водорода, связанные с вторичными углеродными атомами, замещаются легче, чем связанные с первичными. Получать этим методом третичные сульфохлориды не удается из-за обрыва реакционных цепей.
Реакция сульфохлорирования алканов была использована в Германии в 1939-1949 гг. для получения заменителей мыла. Образующиеся при сульфохлорировании углеводородных фракций смеси хлорангидридов сульфокислот действием соды или силикатов превращаются в соли сульфокислот, которые применяются как стиральные порошки:
R-SO2-Cl+2NaOH  R-SO2-ONa+NaCl+H2O
R-SO2-ONa+NaCl+H2O
Сульфоокисление выгоднее, чем сульфохлорирование, так как не расходуется хлор, однако эта реакция еще недостаточно изучена.
3. Нитрование. Реакция нитрования, идет по схеме:
R-H + HO-NO2®R-NO2+H2O.
Концентрированная азотная кислота или смесь азотной и серной кислот окисляют парафины. Нитруются они только разбавленной азотной кислотой при нагревании. В реакцию жидкофазного нитрования вступают все углеводороды, однако скорость реакции невелика и выходы нитросоединений низкие.
В промышленности реализовано нитрование парами азотной кислоты при 250—5000С — парофазное нитрование. Выбор температуры процесса зависит от длины цепи и строения углеводорода: изобутан реагирует уже при 160oС, тогда как метан начинает реагировать только при 370оС. Реакция сопровождается крекингом углеводородов, в результате чего получаются всевозможные мононитропроизводные, начиная от нитропроизводных с тем же числом углеродных атомов, что исходный углеводород, и кончая нитрометаном. Так, в случае нитрования пропана образуется 34% 1-нитропропана СН3-СН2—СН2—NO2, 32% 2-нитропропана СН3—CH(NО2)-CH3, 26% нитроэтана СН3—СН2—NO2 и 8% нитрометана CH3NO2. Полинитросоединения при парофазном нитровании не образуются.
На реакцию нитрования расходуется около 40% азотной кислоты. Остальная кислота действует как окислитель. Поэтому наряду с нитросоединениями в этом процессе получаются и различные кислородные соединения — спирты, альдегиды, кетоны, кислоты. Кроме того, образуются и непредельные углеводороды. Азотная кислота как нитрующий агент может быть заменена окислами азота.
4. Окисление. Действие кислорода воздуха и обычных окислителей (KMnO4, K2CrO4, K2Cr2O7 и др.) проявляется только при высоких температурах, при этом парафины окисляются с разрывом углеродной цепи и образованием преимущественно кислот. При окислении парафинов в значительных количествах получается конечный продукт окисления — диоксид углерода СО2. Окисление низших парафинов протекает с большими затруднениями.
Ввиду того, что окисление парафинов требует высоких температур, в этих условиях также происходит крекинг углеводородов. Поэтому большая часть продуктов окисления имеет меньшее число углеродных атомов, чем исходные углеводороды.
При окислении углеводороды образуют с кислородом (и воздухом) взрывчатые смеси в широком диапазоне концентраций, поэтому приходится работать вне того диапазона, т. е. с очень низкими концентрациями кислорода.
Наибольшее значение имеет окисление высших парафинов нефти с целью получения синтетических высших жирных кислот преимущественно для мыловаренной промышленности.
Окисление высших парафинов проводят при температуре порядка 150оС в присутствии катализаторов, например соединений марганца. При этом образуются смесь кислот с различной длиной цепи, гидроксикислоты, кетокислоты, сложные эфиры, спирты, кетоны и т. д
В процессе окисления предельных углеводородов получаются в качестве промежуточных продуктов органические гидропероксиды. В результате действия на углеводороды высокой температуры образуются свободные радикалы, которые присоединяют молекулярный кислород; возникающий при этом пероксидный радикал отрывает водород от другой молекулы углеводорода и дает новый радикал и молекулу гидропероксида:
R• +  ®ROO•
®ROO• 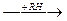 ROOH+R•
ROOH+R•
Дальнейшая судьба гидропероксидов зависит от их строения.
Первая стадия распада любого пероксида — это диссоциация по связи О—О. Возникающие свободные кислородные радикалы либо отрывают водородные атомы от присутствующих в системе водородсодержащих частиц и дают спирты, либо распадаются по b-связи (по отношению к свободной) и дают альдегиды или кетоны.
Третичные гидропероксиды благодаря высокой стойкости в определенных условиях могут быть и конечными продуктами окисления. Они распадаются с образованием спиртов или кетонов по схеме:
5. Крекинг углеводородов. Все предельные углеводороды при температуре выше 1000оС распадаются на углерод и водород. Этот процесс используется как дешевый метод получения водорода и газовой сажи. В определенных условиях удается изолировать промежуточные продукты расщепления, в частности ацетилен. В промышленности реализован способ получения ацетилена пиролизом метана.
Начальная температура распада предельных углеводородов зависит от их молекулярной массы и строения. Чем больше молекулярная масса, тем легче расщепляется углеводород при нагревании.
В интервале температур 300—700оС предельные углеводороды образуют сложную смесь предельных, непредельных и ароматических углеводородов. Чем выше температура и больше глубина превращения, тем меньше состав этой смеси зависит от природы исходного углеводорода.
Основные процессы при крекинге — дегидрогенизация углеводорода и разрыв углеродной цепи. Одновременно происходит изомеризация и циклизация. Промежуточными продуктами во всех этих процессах являются свободные алифатические радикалы.
Продолжительность жизни свободных алифатических радикалов измеряется тысячными долями секунды; т. е. она значительно меньше продолжительности жизни атомарного водорода (0,1 с).
Свободные радикалы способны к следующим основным химическим превращениям:
1) распад
R- CH2 -CH2 ` ® R ` + CH2 = CH2
2) диспропорционирование

3) Рекомбинация (соединение)
R ` + R ` ® R – R
При этом распад свободных радикалов преимущественно вдет по b-связи (по отношению к атому со свободным электроном). Неразветвленные радикалы менее склонны к реакциям диспропорционирования и более склонны к реакциям соединения. Для радикалов с разветвленной цепью наблюдается обратная картина.
Для больших радикалов при распаде характерно образование непредельных углеводородов из остатка с большим числом углеродных атомов.
Скорости отрыва атомов водорода от первичного, вторичного и третичного углеродных атомов соотносятся как 1: 2:10.
В промышленности исключительную роль играет крекинг нефтяного сырья для получения из высших углеводородов более ценных низших предельных и непредельных углеводородов.
Отдельные представители
Первый в ряду предельных углеводородов — метан является основной составной частью природных и попутных газов и широко используется в качестве промышленного и бытового газа. Химически перерабатывается главным образом в ацетилен, газовую сажу, фторо- и хлоропроизводные.
Метан используется для получения:
- синтез-газа (путем частичного окисления), из которого получают метанол, а затем окислением формальдегид, последний используют для производства различного вида пластмасс;
- сажи и водорода (методом пиролиза), водород используется в синтезе аммиака;
- хлористого метила(используемого для синтеза диметилдихлорсилана и силиконов), хлористого метилена, хлороформа, четыреххлористого углерода (используемого для синтеза фреона);
- нитрометана (путем нитрования), который используется производства взрывчатых веществ;
- синильной кислоты (методом аминолиза), которая используется для получения акрилонитрила, широко применяемого при синтезе волокон и нитрильного каучука;
- ацетилена, путем высокотемпературного пиролиза.
Этан, пропан, бутан и пентаны используются о технике для получения соответственно этилена, пропилена, дивинила и изопрена (дегидрирование, в последнем случае с изомеризацией). Смесь пропана и бутана используют в качестве топлива (бытовой сжиженный газ). В последнее время значительные количества бутана используют в технике для получения уксусной кислоты (окисление).
Жидкие парафины используются как компоненты моторного топлива. Для двигателей внутреннего сгорания требуется топливо с высоким «октановым числом».
За нуль в этой шкале принят н-гептан, за 100 — изооктан. Если исследуемое топливо детонирует так же, как смесь 76 % изооктана и 24% н-гептана, то топливу присваивается октановое число 76. В настоящее время в качестве топлива для легковых автомобилей используется бензин с октановыми числами 76, 93, 95 и 98.
Изооктан получают из изобутана и изобутилена (реакция алкилирования). Высшие жидкие и твердые парафины используются как топливо (дизельное), смазочный материал, в виде твердого парафина, озокерита и т. д.
Контрольные вопросы по теме 2






