В отличие от ионпо-металлпческпх электродов, где металл и раствор обмениваются катионами, в окислительно-восстановительных (О — В) электродах между этими фазами осуществляется электронный обмен. Для установления равновесного окислительно-восстановительного потенциала необходимо прежде всего, чтобы: ионы металлов не переходили через границу фаз. Растворение или осаждение металла должно быть полностью подавлено, т. е. металл должен быть совершенно инертен. Возникновение окислительно-восстановительных потенциалов - 59
Раствор О — В электрода должен обязательно содержать два компонента (например, поны Fe3+ п Fe2+), которые при передаче электрона нз раствора в металл плп обратно могут взаимно переходить друг в друга. В свою очередь эти компоненты могут находиться в равновесии с другими веществами.
Механизм установления определенной разности потенциалов на границе металл — раствор основывается и подобной системе на том, что металл с какой-то скоростью отдает электроны окисленной форме вещества и одновременно получает их от восстановленной (в нашем примере соответственно поны Fea+ и Fe-+).
Если каким-то способом сообщить электроду начальный потенциал, при котором плотность тока, соответствующая первому процессу, окажется выше, то при отсутствии внешнего тока металл начнет заряжаться по отношению к раствору более положительно. Переход электронов в раствор при этом: будет постепенно затрудняться, а переход пх в обратном направлен ни будет становиться все легче. Соответственно ток отдачи электронов металлом будет падать, а обратный ток — расти. Если, наоборот, начальный потенциал окажется настолько высоким, что будет преобладать ток перехода электронов нз раствора в металл, то разность потенциалов металл — раствор в отсутствие внешнего тока начнет самопроизвольно сдвигаться в отрицательном направлении. II снова это будет приводить к самоторможению более быстрого в данных условиях процесса и к ускорению противоположного.
В обоих случаях самопроизвольное- изменение разности потенциалов металл — раствор прекратится в тот момент, когда она достигнет значения, при котором плотности прямого и обратного токов будут равны друг другу. Установится некоторая характерная для дайной системы разность потенциалов. В сумме с остальными межфазньшн разностями потенциалов, которые существуют в iальванпчоской цепи, образованной данным электродом и электродом сравнения, эта разность н составляет так называемый окислительно-восстановительный потенциал.
Скорость отдачи электронов металлом должна зависеть от концентрации компонента, который является их акцептором (у пас Fe:i+), а скорость их присоединения к металлу — от концентрации компонента — донора (Fe2+). Понятно поэтику, что п окпелптельно-воестаповитсльпый потенциал электрода должен зависеть от названных концентраций.
Иногда полагают, что для установления окислительно-восстановительного потенциала может быть необходимо промежуточное образование атомарного водорода, но это неверно.
47. Отличительным признаком окислительно-восстановительных (редокс-) реакций является перенос электронов между реагирующими частицами – ионами, атомами, молекулами, комплексами, в результате чего изменяется степень окисления реагирующих частиц, например,
Fe2+ - e- → Fe3+.
Поскольку электроны не могут накапливаться в растворе, одновременно должны протекать два процесса – отдача и принятие электронов, т. е. процесс окисления одних и восстановления других частиц. Таким образом, любая окислительно-восстановительная реакция всегда может быть представлена в виде двух полуреакций
aОx1 + bRed2 → аRed1 + bОx2,
аОx1 + nе- → aRed1,
bRed2 – nе- → bОx2,
где Ox – окисленная форма, Red – восстановленная форма.
Исходная частица и продукт каждой полуреакции составляют сопряженную окислительно-восстановительную пару или систему. Иными словами, в вышеприведенных полуреакциях Red1 является сопряженным с Оx1, а Оx2 сопряжен с Red2.
В качестве доноров или акцепторов электронов могут выступать не только частицы, находящиеся в растворе, но и электроды. В этом случае окислительно-восстановительная реакция происходит на границе электрод-раствор и называется электрохимической.
Окислительно-восстановительные реакции, как и все динамические процессы, в той или иной мере обратимы. Направление реакций определяется соотношением электронодонорных свойств компонентов системы одной окислительно-восстановительной полуреакции и электроно-акцепторных свойств второй (при условии постоянства факторов, влияющих на смещение равновесных химических реакций). Перемещение электронов в ходе окислительно-восстановительных реакций приводит к возникновению потенциала. Таким образом, потенциал, измеряемый в вольтах, служит мерой окислительно-восстановительной способности соединения.
Стандартные потенциалы. Для количественной оценки окислительных (восстановительных) свойств системы в раствор погружают электрод из химически инертного (индифферентного) токопроводящего материала. На границе раздела фаз (электрод-раствор) происходит электронообразующий процесс, приводящий к возникновению потенциала, являющегося функцией активности ионов в растворе. Значение потенциала тем больше, чем выше окислительная способность окисленной формы.
Абсолютное значение потенциала системы измерить невозможно. Однако, если выбрать одну из окислительно-восстановительных систем в качестве стандартной, то относительно нее становится возможным измерение потенциала любой другой окислительно-восстановительной системы независимо от выбранного индифферентного электрода. В качестве стандартной выбирают систему 2Н+/Н2, потенциал которой [при =1,013.103 Па (1 атм) и aH+ = 1 моль/л при 298 К] принят равным нулю. При таких условиях электродвижущая сила (ЭДС) гальванической цепи
Стандартный водородный │Раствор окислительно- │ Pt
электрод восстановительной системы
определяется составом раствора, содержащего данную окислительно-восстановительную пару.
Потенциал любой окислительно-восстановительной системы, измеренный в стандартных условиях относительно водородного электрода, называют стандартным потенциалом (Е°) этой системы.
Стандартный потенциал окислительно – восстановительной системы принято считать положительным, если она выступает в качестве окислителя, а на водородном электроде протекает полуреакция окисления
Н2 – 2е- → 2Н+,
или отрицательным, если система играет роль восстановителя, а на водородном электроде происходит полуреакция восстановления
2Н+ + 2е- → Н2.
Значение стандартного потенциала характеризует «силу» окислителя или восстановителя.
В справочной литературе в форме таблиц представлены стандартные окислительно-восстановительные потенциалы наиболее часто встречающихся систем.
Стандартный потенциал – термодинамическая стандартизованная величина – является очень важным физико-химическим и аналитическим параметром, позволяющим оценить направление соответствующей реакции и рассчитывать активности реагирующих частиц в условиях равновесия.
Реальные потенциалы. Использование стандартных потенциалов применительно к конкретным растворам окислительно-восстановительных систем часто встречает серьезные затруднения. Значение стандартного потенциала характеризует полуреакцию, участниками которой являют частицы одного «вида» без учета всех прочих возможных форм их существования в конкретных условиях (комплексы, полимерные частицы, ассоциаты и т.д.) и без учета межионного взаимодействия.
Для характеристики окислительно-восстановительной системы в конкретных условиях пользуются понятием реального (формального) потенциала Е. Для вычисления реального потенциала полуреакции аОx + nе- → bRed,
пользуются уравнением Нернста:
Е= Е° + (RT/nF)ln(aaОx/abRed),
где Е° - стандартный потенциал, В; R - универсальная газовая постоянная, равная 8,314 Дж.моль-1.К-1; Т- абсолютная температура, К; n- число электронов, участвующих в полуреакции; F- постоянная Фарадея 9,6585.104 Кл×моль-1; а – активности окисленной и восстановленной форм.
После подстановки указанных величин (Т=298 К) и замены натурального логарифма десятичным, а также при замене активностей концентрацями уравнение Нернста приводится к виду:
Е=Е° + (0,059/n)lg([Оx1]a/ [Red1]b).
[Ox1], [Red1]- концентрации окисленной и восстановленной форм соответственно;
a, b –стехиометрические коэффициенты в уравнении рассматриваемой реакции.
48. Гальвани́ческий элеме́нт — химический источник электрического тока, основанный на взаимодействии двух металлов и (или) их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Назван в честь Луиджи Гальвани.
Топливный элемент — электрохимическое устройство, подобное гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне[1] — в отличие от ограниченного количества энергии, запасенного в гальваническом элементе или аккумуляторе.
Топливные элементы осуществляют превращение химической энергии топлива в электричество, минуя малоэффективные, идущие с большими потерями, процессы горения. Это электрохимическое устройство в результате высокоэффективного «холодного» горения топлива непосредственно вырабатывает электроэнергию.
Естественным топливным элементом является митохондрия живой клетки. Митохондрии перерабатывают органическое «горючее» — пируваты и жирные кислоты, синтезируя АТФ — универсальный источник энергии для всех биохимических процессов в живых организмах, одновременно создавая разность электрических потенциалов на своей внешней мембране. Однако, копирование этого процесса для получения электроэнергии в промышленных масштабах лишено смысла, т.к. на долю электрической разности потенциалов приходятся ничтожная доля химической энергии исходных веществ: почти вся энергия передаётся молекулам АТФ.
Электри́ческий аккумуля́тор — химический источник тока многоразового действия, основная специфика которого заключается в обратимости внутренних химических процессов, что обеспечивает его многократное циклическое использование (через заряд-разряд[1]) для накопления энергии и автономного электропитания различных электротехнических устройств и оборудования[2].
Принцип действия аккумулятора основан на обратимости химической реакции. Работоспособность аккумулятора может быть восстановлена путём заряда, то есть пропусканием электрического тока в направлении, обратном направлению тока при разряде.
Несколько аккумуляторов, объединённых в одну электрическую цепь, составляют аккумуля́торную батаре́ю.
49. Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор либо расплав электролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами — проводниками, соединёнными с полюсами источника электрической энергии. Анодом при электролизе называется положительный электрод, катодом — отрицательный[1]. Положительные ионы — катионы — (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Явление электролиза широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, водорода, а также гидроксида натрия, хлора, хлорорганических соединений[источник не указан 1318 дней], диоксида марганца[2], пероксида водорода. Большое количество металлов извлекаются из руд и подвергаются переработке с помощью электролиза (электроэкстракция, электрорафинирование). Также, электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
Окислительно-восстановительное разложение вещества под действием внешнего источника тока называется электролизом. Вещество можно «разложить» электрическим током, если оно является проводником II-го рода, т.е. находится в жидком расплавленном или растворенном состоянии и проводит электрический ток за счет перемещения ионов, т.е. является электролитом.
Функции анода и катода при электролизе такие же, как и при работе гальванического элемента, т.е. на аноде идет процесс окисления, а на катоде – процесс восстановления. Но, в отличие от гальванического элемента, анод заряжен в электролизере положительно, а катод – отрицательно:
Электролизер │ Гальванический элемент
анод – окисление (+) │ анод – окисление (–)
катод- восстановление (–) │ катод – восстановление (+).
Токоподводящие электроды при этом могут не участвовать в окислительно-восстановительном процессе (быть химически инертными), или выступать в роли окислителя или восстановителя (быть химически активными). Активными электродами являются, как правило, металлические электроды из металлов d-подгрупп, а инертными - графитовые или платиновые электроды.
Для иллюстрации процессов электролиза рассмотрим несколько частных примеров.
Пример А. Электролиз расплавленного электролита на активных и пассивных электродах.
Случай I. Электролиз расплава гидроксида натрия NaOH на графитовых (пассивных) электродах. Схема электролиза:
катод (–) ←— Na+ + OH– —→ (+) анод
катодный процесс:Na+ + ē → Na│2OH– – 2ē → ½O2↑ + H2O: анодный процесс
φ0Na|Na+ = – 2,71В│ φ02ОН–|½O2 = +0,41В.
Полное уравнение окислительно-восстановительного процесса:
2NaOH = 2Na + ½O2↑ + H2O.
Его разность потенциалов ΔЕ = φА – φК = 0,40 – (–2,71) = +3,11В. Понятно, что внешний источник тока должен обладать не меньшей ЭДС для преодоления разности потенциалов и осуществления электролиза расплава щелочи.
Случай II. Электролиз расплава хлорида меди CuCl2 на медных (Cu) электродах. Схема электролиза:
катод (–) ←— Cu2+ + 2Cl– —→ (+) анод
катодный процесс: анодный процесс:
Cu2+ + 2ē = Cu │а)2Cl– – 2ē = Cl2↑, φ0 2Cl–|Cl2 = 1,36B, или
φ0 Сu2+|Сu = –0,34B. │б) Cu – 2ē = Cu2+, φ0 Cu|Cu2+ = 0,34B.
Разность потенциалов при реализации на аноде процесса а) составляет ΔЕа = 1,70В, а при реализации процесса б) составляет значительно меньшую величину ΔЕб = 0,68В.Следовательно, процесс б) энергетически более выгоден, ему и будет отдано предпочтение.
И тогда полное уравнение окислительно-восстановительного процесса при электролизе будет иметь вид: CuCl2(K) + Cu(A) = CuCl2(A) + Cu(K).
Таким образом, продуктами электролиза расплава соли меди на медных электродах является катодная медь, прочно удерживаемая медной подложкой электрода, растворяющийся анод в результате расходования части металла на его окисление, и не изменяющаяся концентрация электролита, который служит только для переноса электричества через раствор.
50. В учебниках и научной литературе можно найти несколько версий формулировки законов. В наиболее общем виде законы формулируются следующим образом:
Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
Законы Фарадея можно записать в виде следующей формулы:
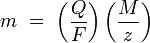
где:
m — масса осаждённого на электроде вещества в граммах
Q — полный электрический заряд, прошедший через вещество
F = 96 485,3383(83) Кл·моль−1 — постоянная Фарадея
M — молярная масса вещества
z — валентное число ионов вещества (число электронов на один ион).
Заметим, что M/z — это эквивалентная масса осаждённого вещества.
Для первого закона Фарадея M, F и z являются константами, так что чем больше величина Q, тем больше будет величина m.
Для второго закона Фарадея Q, F и z являются константами, так что чем больше величина M/z (эквивалентная масса), тем больше будет величина m.
В простейшем случае постоянного тока электролиза приводит к:
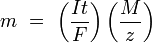
и тогда
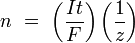
где:
n — выделенное количество вещества («количество молей»): n = m/M
t — время действия постоянного тока.
В более сложном случае переменного электрического тока полный заряд Q тока I() суммируется за время:
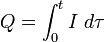
Здесь t — полное время электролиза. Обратите внимание, что тау используется в качестве переменной, ток I является функцией от тау.[2]
Для электролиза расплавов, в отличие от электролиза растворов, характерно протекание процесса при высоких температурах в специально подготовленных для этого электролизерах с инертными электродами. Например, как при электролизе расплава хлорида натрия.
Электролиз расплавленных солей, содержащих анионы кислородсодержащих кислот (SO42-; CO32-; NO3- и др.) используется на практике значительно реже. Рассмотрим электролиз расплава сульфата калия.
Катодный процесс проходит также как и в примере с хлоридом натрия. Анодный процесс сопровождается окислением SO42- до анионов надсерной (или пероксодисерной) кислоты S2O82-, которые при высокой температуре разлагаются с образованием кислорода, оксида серы (IV) и сульфат-иона.
51. Корро́зия (от лат. corrosio — разъедание) — это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. В общем случае это разрушение любого материала, будь то металл или керамика, дерево или полимер. Причиной коррозии служит термодинамическая неустойчивость конструкционных материалов к воздействию веществ, находящихся в контактирующей с ними среде. Пример — кислородная коррозия железа в воде: 4Fe + 6Н2О + ЗО2 = 4Fe(OH)3. Гидратированный оксид железа Fe(OН)3 и является тем, что называют ржавчиной.
В повседневной жизни для сплавов железа (сталей) чаще используют термин «ржавление». Менее известны случаи коррозии полимеров. Применительно к ним существует понятие «старение», аналогичное термину «коррозия» для металлов. Например, старение резины из-за взаимодействия с кислородом воздуха или разрушение некоторых пластиков под воздействием атмосферных осадков, а также биологическая коррозия. Скорость коррозии, как и всякой химической реакции, очень сильно зависит от температуры. Повышение температуры на 100 градусов может увеличить скорость коррозии на несколько порядков.






