Влияние температуры
Влияние температуры зависит от знака теплового эффекта реакции. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции. В общем же случае при изменении температуры химическое равновесие смещается в сторону процесса, знак изменения энтропии в котором совпадает со знаком изменения температуры. Зависимость константы равновесия от температуры в конденсированных системах описывается уравнением изобары Вант-Гоффа:

в системах с газовой фазой — уравнением изохоры Вант-Гофф
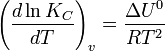
В небольшом диапазоне температур в конденсированных системах связь константы равновесия с температурой выражается следующим уравнением:
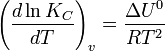
Например, в реакции синтеза аммиака
N2 + 3H2 ⇄ 2NH3 + Q
тепловой эффект в стандартных условиях составляет +92 кДж/моль, реакция экзотермическая, поэтому повышение температуры приводит к смещению равновесия в сторону исходных веществ и уменьшению выхода продукта.
Влияние давления
Давление существенно влияет на положение равновесия в реакциях с участием газообразных веществ, сопровождающихся изменением объёма за счёт изменения количества вещества при переходе от исходных веществ к продуктам:
При повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов и наоборот.
В реакции синтеза аммиака количество газов уменьшается вдвое: N2 + 3H2 ↔ 2NH3
Значит, при повышении давления равновесие смещается в сторону образования NH3, о чём свидетельствуют следующие данные для реакции синтеза аммиака при 400 °C
| давление, МПа | 0,1 | |||||
| объемная доля NH3, % | 0,4 |
Влияние инертных газов
Введение в реакционную смесь или образование в ходе реакции инертных газов действует так же, как и понижение давления, поскольку понижается парциальное давление реагирующих веществ. Следует отметить, что в данном случае в качестве инертного газа рассматривается газ, не участвующий в реакции. В системах с уменьшением количества молей газов инертные газы смещают равновесие в сторону исходных веществ, поэтому в производственных процессах, в которых могут образовываться или накапливаться инертные газы, требуется периодическая продувка газоводов.
Влияние концентрации
Влияние концентрации на состояние равновесия подчиняется следующим правилам:
- При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
- При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
23. МНОГОКОМПОНЕНТНЫЕ СИСТЕМЫ, физ.-хим. системы, содержащие не менее трех компонентов. Компонентами системы наз. вещества, изменения масс которых независимы и выражают все возможные изменения в составе системы. Если в системе отсутствуют обратимые хим. реакции, число компонентов равно числу веществ, содержащихся в системе. В случае систем с хим. превращениями число компонентов равно разности между числом сортов частиц, содержащихся в системе, и числом независимых реакций. Это объясняется тем, что условия хим. равновесия выражаются как количеств. связи между концентрациями веществ, а число таких связей равно числу независимых хим. реакцийЧисло компонентов, вообще говоря, зависит от условий, в которых находится система. Изменяя условия, можно инициировать или тормозить хим. реакции и тем самым менять число связей, накладываемых на изменения. концентраций веществ. Число компонентов может зависеть от точности экспе-рим. исследования, т.к. в отдельных случаях требуетсяучитывать концентрации веществ, присутствующих в очень малых кол-вах. Числа молей всех компонентов mi (i = 1, 2,..., n)характеризуют не только соотношение между ними, но и общую массу n-компонентной системы (фазы). Поэтому для задания состава многокомпонентные системы чаще используют молярные доли компонентов xi = mi /(m1 + т2 +... + mn), которые подчинены условию x1 + х2 +... + xn = 1, и, следовательно, только (п — 1) из них являются независимыми.
Растворитель (от латинского solvere, «ослабить») — жидкое, твёрдое или газообразное вещество, способное растворять другие твёрдые, жидкие или газообразные вещества, которые растворяются в определённом объёме растворителя при заданной температуре. Обычно используются как органические растворители в химчистках (например, тетрахлорэтилен), как растворители (например, толуол, скипидар), для удаления лаков и клея (ацетон, метиловый спирт, этилацетат), в моющих средствах (цитрусовые терпены), в парфюмерии (этанол) и в химическом синтезе. Обычно растворитель и растворяемое вещество одинаковы по своей природе — подобное растворяется в подобном, то есть полярный растворитель подходит к полярному веществу. Например низшие спирты растворяются в высших.
Solute — Растворенное вещество.Компонент жидкого или твердого раствора, который присутствует в меньшем или незначительном количестве; компонент растворяется в Solvent — Растворителе.
24. Газообразными растворами являются воздух и другие смеси газов.
К жидким растворам относят гомогенные смеси газов, жидкостей и твердых тел с жидкостями.
Твердыми растворами являются многие сплавы, например, металлов друг с другом, стёкла. Наибольшее значение имеют жидкие смеси, в которых растворителем является жидкость.
Идеальным раствором называют раствор, для которого выполняется первый закон Рауля.
Идеальными при любых концентрациях являются растворы, компоненты которых близки по физическим и химическим свойствам и образование которых не сопровождается объёмными и тепловыми эффектами. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором.
25. Гидраты — продукты присоединения воды к неорганическим и органическим веществам.
Этот термин раньше широко применялся для всех соединений, выделяющих воду при нагревании. Так NaOH называли гидратом окиси натрия. Однако сейчас гидратами называют только соединения, в которых молекула воды присутствует в виде отдельной структурной единицы. Джон Кэрролл в своей книге «Гидраты природного газа» даёт следующее определение гидратов, которое применяется в нефтегазовой промышленности: «„Гидратами“ называют вещества, которые при комнатной температуре обычно находятся в газообразном состоянии. В число таких веществ входят метан, этан, двуокись углерода и сероводород. Отсюда возник термин „газовые гидраты“, а также одно из широко распространённых заблуждений, связанных с этим видом соединений. Многие ошибочно полагают, что неводные жидкости неспособны к гидратообразованию, однако на самом деле гидраты могут образовываться и другими жидкостями. В качестве примера вещества, которое при комнатных условиях находится в жидком состоянии, но всё же образует гидрат, можно назвать дихлордифторметан (фреон-12).» Причину образования гидратов Дж. Кэрролл объясняет так: «Способность воды образовывать гидраты объясняется наличием в ней водородных связей. Водородная связь заставляет молекулы воды выстраиваться в геометрически правильные структуры. В присутствии молекул некоторых веществ эта упорядоченная структура стабилизируется и образуется смесь, выделяемая в виде твёрдого осадка. Молекулы воды в таких соединениях называются „хозяевами“, а молекулы других веществ, стабилизирующие кристаллическую решётку — „гостями“ (гидратообразователями). Кристаллические решётки гидратов имеют сложное, трёхмерное строение, где молекулы воды образуют каркас, в полостях которого находятся заключённые молекулы-гости. Считается, что стабилизация кристаллической решётки в присутствии молекул-гостей обусловлена ван-дер-ваальсовыми силами, которые возникают из-за межмолекулярного притяжения, не связанного с электростатическим притяжением. Ещё одна интересная особенность газовых гидратов заключается в отсутствии связей между молекулами-гостями и хозяевами. Молекулы-гости могут свободно вращаться внутри решёток, образованных молекулами-хозяевами. Таким образом, данные соединения лучше всего описать как твёрдые растворы».
СОЛЬВАТЫ, продукты присоединения р-рителя к растворенным в-вам. Частный случай сольватов-гидраты (р-ритель-вода). Обычно сольваты образуются в р-ре, но нередко (при охлаждении р-ра, испарении р-рителя и др.) м. б. получены в виде кристаллич. фаз-кристаллосольватов. Напр., из р-ра LiCl в метаноле и в жидком NH3 кристаллизуются соотв. LiCl·4CH3OH и LiCl·5NH3. В структуре кристалло-сольватов солей молекулы р-рителя обычно группируются вокруг катиона, удерживающего их в результате образования донорно-акцепторной связи. Поэтому многие сольваты можно рассматривать как координац. соед.-сольватокомплексы. Прочность связи катиона с р-рителем растет с увеличением заряда катиона и с уменьшением его радиуса. Частно координац. число катиона одинаково или близко в разных р-рителях, напр.: для LiCl+ оно обычно равно 4-5. К крис-таллосольватам близки аддукты, напр. SbCl5·NH2C6H5, где связь атома элемента с лигандом также донорно-ак-цепторная. К сольватам близки также клатраткомплексы (см. Клат-раты), обычно существующие в твердой фазе, но иногда и в р-ре.
СОЛЬВАТЫ, кристаллосольвата продукты присоединения растворителя к растворенным веществам. Частный случай сольваты-гидраты (р-ритель-вода). Обычно сольваты образуются в растворе, но нередко (при охлаждении раствора, испарении растворителя и др.) м. б. получены в виде кристаллич. фаз-кристаллосольватов. Напр., из раствора LiCl в метаноле и в жидком NH3 кристаллизуются соотв. LiCl·4CH3OH и LiCl·5NH3. В структуре кристалло-сольватов солей молекулы растворителя обычно группируются вокруг катиона, удерживающего их в результате образования донорно-акцепторной связи. Поэтому многие сольваты можно рассматривать как координац. соед.-сольватокомплексы. Прочность связи катиона с растворителем растет с увеличением заряда катиона и с уменьшением его радиуса. Частно координац. число катиона одинаково или близко в разных растворителях, например: для LiCl+ оно обычно равно 4-5. К крис-таллосольватам близки аддукты. например SbCl5·NH2C6H5, где связь атома элемента с лигандом также донорно-ак-цепторная. К сольваты близки также клатраткомплексы (см. Клат-раты), обычно существующие в твердой фазе, но иногда и в растворе.
Любое растворенное вещество в той или иной степени сольва-тировано (см. Сольватация), но говорить об образовании в растворе сольваты определенного состава можно тогда, когда взаимод. растворенного вещества с молекулами растворителя значительно интенсивнее, чем молекул растворителя друг с другом. Так, ионы d-элементов 3-го периода в растворах часто прочно связаны с 6 молекулами растворителя, образуя сольватокомплексы [ЭL6]n+ (Э-ион элемента, L-лиганд).
Слой молекул растворителя, связанный с центр. частицей сольваты, наз. сольватной оболочкой (сферой). Многозарядные ионы могут удерживать молекулы растворителя также и во второй сольватной сфере. Выделяющиеся из растворов кристал-лосольваты солей часто имеют др. состав, чем сольваты в растворе, т. к. координац. места растворителя в кристаллах занимают анионы или фрагменты анионов, например атомы кислорода оксоанио-нов. По составу кристаллосольвата. как правило, нельзя судить о составе сольваты в растворе.
Кристаллогидраты — кристаллы, содержащие молекулы воды и образующиеся, если в кристаллической решётке катионы образуют более прочную связь с молекулами воды, чем связь между катионами и анионами в кристалле безводной соли. При низких температурах вода в кристаллогидратах может быть связана как с катионами, так и с анионами солей. Многие соли, а также кислоты и основания выпадают из водных растворов в виде кристаллогидратов.
Примеры
Типичными кристаллогидратами являются многие природные минералы, например гипс CaSO4·2H2O, карналлит MgCl2·KCl·6H2O. Кристаллизационная вода обычно может быть удалена нагреванием, при этом разложение кристаллогидрата часто идёт ступенчато. Так, медный купорос CuSO4·5H2O (синий) выше 105 °C переходит в тригидрат CuSO4·3H2O (голубой), при 150 °C в моногидрат CuSO4·H2O (белый); полное обезвоживание происходит выше 250 °C. Однако некоторые соединения (например, BeC2O4·H2O) устойчивы только в форме кристаллогидрата и не могут быть обезвожены без разложения. Другие примеры: железный купорос FeSO4·7H2O, кристаллическая сода Na2CO3·10H2O.
Растворимость газов в жидкостях
Растворимость газов в жидкостях зависит от ряда факторов: природы газа и жидкости, давления, температуры, концентрации растворенных в жидкости веществ (особенно сильно влияет на растворимость газов концентрация электролитов).
Наибольшее влияние на растворимость газов в жидкостях оказывает природа веществ. Так, в 1 литре воды при t = 18 °С и P = 1 атм. растворяется 0.017 л. азота, 748.8 л. аммиака или 427.8 л. хлороводорода. Аномально высокая растворимость газов в жидкостях обычно обусловливается их специфическим взаимодействием с растворителем – образованием химического соединения (для аммиака) или диссоциацией в растворе на ионы (для хлороводорода). Газы, молекулы которых неполярны, растворяются, как правило, лучше в неполярных жидкостях – и наоборот. Зависимость растворимости газов от давления выражается законом Генри – Дальтона:
Растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью.
C=kP (7)
Здесь С – концентрация раствора газа в жидкости, k – коэффициент пропорциональности, зависящий от природы газа. Закон Генри – Дальтона справедлив только для разбавленных растворов при малых давлениях, когда газы можно считать идеальными. Газы, способные к специфическому взаимодействию с растворителем, данному закону не подчиняются.
Растворимость газов в жидкостях существенно зависит от температуры; количественно данная зависимость определяется уравнением Клапейрона – Клаузиуса (здесь X – мольная доля газа в растворе, λ – тепловой эффект растворения 1 моля газа в его насыщенном растворе):
 (8)
(8)
Как правило, при растворении газа в жидкости выделяется теплота (λ < 0), поэтому с повышением температуры растворимость уменьшается. Растворимость газов в жидкости сильно зависит от концентрации других растворенных веществ. Зависимость растворимости газов от концентрации электролитов в жидкости выражается формулой Сеченова (X и Xo – растворимость газа в чистом растворителе и растворе электролита с концентрацией C):
 (9)
(9)






