Поскольку сильные электролиты диссоциируют практически полностью, можно было бы ожидать для них изотонический коэффициент, равный количеству ионов (или поляризованных атомов) в формульной единице (молекуле). Однако в действительности этот коэффициент всегда меньше определённого по формуле. Например, изотонический коэффициент для 0,05-моляльного раствора NaCl равен 1,9 вместо 2,0 (для раствора сульфата магния той же концентрации и вовсе i = 1,3). Это объясняет теория сильных электролитов, разработанная в 1923 году П. Дебаем и Э. Хюккелем: передвижение ионов в растворе затруднено образовавшейся оболочкой сольватации. К тому же, ионы взаимодействуют и между собой: разноимённо заряженные притягиваются, а одноимённо заряженные — отталкиваются; силы взаимного притяжения приводят к образованию групп ионов, перемещающихся по раствору совместно. Такие группы называют ионными ассоциатами или ионными па́рами. Соответственно, раствор ведёт себя так, будто содержит меньше частиц, чем на самом деле, ведь свобода их перемещения ограничена. Наиболее очевиден пример, касающийся электропроводности растворов λ, которая возрастает с разбавлением раствора. Через отношение реальной электропроводности к таковой при бесконечном разбавлении определяют мнимую степень диссоциации сильных электролитов, также обозначаемую через α:
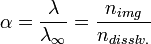
где nimg — мнимое, а ndisslv. — реальное количество частиц в растворе.
Влияние внешних факторов
Очевидно, что взаимодействие ионов уменьшается с повышением температуры (вследствие возросшего теплового движения частичек), а также с уменьшением их концентрации, то есть, разбавлением раствора, ведь тогда уменьшается вероятность встречи двух частичек. Экстраполируя разбавление в сторону бесконечности, коэффициент i стремится к своему максимальному значению, определяемому по формуле растворённого соединения. Степень диссоциации α, в соответствии с вышеупомянутой формулой зависимости между i и α, одновременно возрастает, приближаясь к единице (1).
Изотонический коэффициент был введён в последней четверти XIX века Я. Х. Вант-Гоффом. В 1901 году он первым получил Нобелевскую премию по химии — за свои заслуги в изучении растворов.
31. Основные положения теории Аррениуса
1 Соли, кислоты и основания при растворении в воде и некоторых других полярных растворителях диссоциируют на ионы.
2 Ионы существуют в растворе независимо от того, проходит через раствор электрический ток или нет. Вследствие этого число независимо движущихся частиц растворенного вещества больше, чем при отсутствии диссоциации, и коллигативные свойства электролитов возрастают в i раз.
3 Процесс диссоциации описывается законом действующих масс (протекает обратимо). При уменьшении концентрации диссоциация становится практически полной
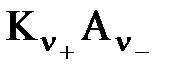 ↔ ν+ Kz+ + ν – Az-
↔ ν+ Kz+ + ν – Az-
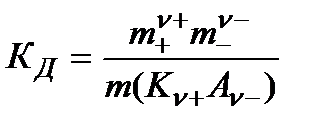
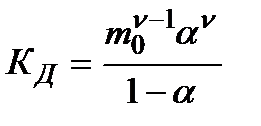
В частном случае при ν+=ν–=1
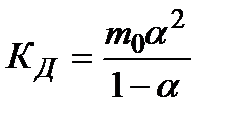 (*)
(*)
Здесь ν=ν++ν– - общее число ионов, образующихся при диссоциации одной молекулы,
m+, m– - моляльности ионов,
m(Kν+Aν–) – моляльность недиссоциированных молекул,
m0 – моляльность раствора при расчете на полностью недиссоциированное вещество,
α – степень диссоциации – доля диссоциированных молекул,
КД – практическая константа диссоциации.
Коэффициент Вант-Гоффа i – изотонический коэффициент – связан со степенью электролитической диссоциации. i – среднее суммарное число частиц (ионов и молекул), образующихся при диссоциации одной молекулы
i = ν + α + ν- α + (1-α) = 1 + (ν++ν–-1)α = 1 + (ν – 1)α i = 1+(ν-1)α
По мере увеличения разведения коэффициент Вант-Гоффа приближается к простому целому числу (2,3,4 – в зависимости от числа ионов, образующихся при растворении молекул вещества):
кислоты - вещества, диссоциирующие на катионы водорода и анионы кислотного остатка
основания - вещества, диссоциирующие на катионы металла и анионы гидроксила
соли - вещества, диссоциирующие на катионы металла и анионы кислотного остатка
32. Электролитическая диссоциация слабых электролитов, согласно теории Аррениуса, является обратимой реакцией, то есть схематически её можно представить уравнениями (для одновалентных ионов:):
KA ↔ K+ + A−,
где:
KA — недиссоциированное соединение;
K+ — катион;
A− — анион.
Константу равновесия такой реакции можно выразить уравнением:, (1)
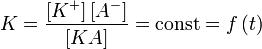
где:
[KA] — концентрация недиссоциированного соединения в растворе;
[K+] — концентрация катионов в растворе;
[A−] — концентрация анионов в растворе.
Константу равновесия применительно к реакции диссоциации называют константой диссоциации.
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах.
"Степень диссоциации это есть отношения числа продиссоциируемых молекул к общему числу молекул и умноженному на 100%":
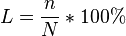
числа распавшихся на ионы молекул к общему числу растворенных молекул.
Степень диссоциации равна отношению числа диссоциированных молекул к сумме, где — число недиссоциированных молекул. Часто выражают в процентах. Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
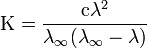
Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства
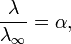
где α — степень диссоциации.
Закон разбавления Оствальда выведен В.Оствальдом в 1888 и им же подтвержден опытным путём. Экспериментальное установление правильности закона разбавления Оствальда имело большое значение для обоснования теории электролитической диссоциации.
33. Ионные реакции — реакции между ионами в растворе. Например, реакцию
AgNO3 + NaCl = NaNO3 + AgCl
можно представить в ионном виде (реакция расписывается на ионы, не расписываются осадки, газы, вода, слабые кислоты и основания, а также малорастворимые и нерастворимые соединения) например AgCl нерастворим в воде и на ионы не расписывается:
Ag+ + NO3− + Na+ + Cl− = AgCl + Na+ + NO3−
Одинаковые ионы сокращаются и получается сокращенное ионное уравнение. Так как взаимодействие произошло между ионами Ag+ и ионами Cl−, то выражение
Ag+ + Cl− = AgCl
и есть ионное уравнение рассматриваемой реакции. Оно проще молекулярного и в то же время отражает сущность происходящей реакции.
ИОННОЕ РАВНОВЕСИЕ, равновесное состояние, существующее в растворах ЭЛЕКТРОЛИТОВ. Сильные кислоты и основы полностью распадаются на ИОНЫ в ВОДНЫХ РАСТВОРАХ, а слабые кислоты или основы только частично. Электролит АВ, может частично распасться на А+ и В- когда его помещают в раствор [А+] [В-]/[АВ], где [ ] означает активность, - и есть константа, которую называют константой равновесия.
Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:
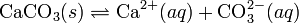
Константа этого равновесия рассчитывается по уравнению:

В приближении идеального раствора с учётом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:
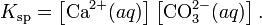
Константа равновесия такого процесса называется произведением растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m ионов An+ и n ионов Bm-, рассчитывается по уравнению:
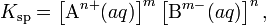
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
Активность отличается от общей концентрации на некоторую величину. Отношение активности () к общей концентрации вещества в растворе называется коэффициентом активности:
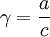
Коэффициент активности служит мерой отклонения поведения раствора (или компонента раствора) от идеального. Отклонения от идеальности могут быть обусловлены различными химическими и физическими причинами — дипольные взаимодействия, поляризация, образование водородных связей, ассоциация, диссоциация, сольватация и др.[1] Исходя из понятия химического потенциала, активность компонента в растворе можно определить как величину, которую нужно подставить в выражения для химического потенциала компонента в идеальном растворе:
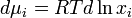
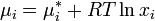
(где — химический потенциал чистого -го компонента) вместо мольной доли x, для того, чтобы получить действительное значение химического потенциала -го компонента в реальном растворе:
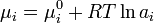
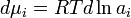
где — стандартный химический потенциал[2].
Размерность и величина активности зависит от используемого способа выражения концентрации — если (активность при выражении концентрации как мольной доли) величина безразмерная, то и (для молярности и моляльности соответственно) — размерные величины, выражаются в моль/л и моль/кг.
В теории дистилляции активность компонента жидкости представляется как давление пара компонента в сравнении с давлением пара чистого компонента:. При этом, где N – молярная доля компонента в жидкости, γ –коэффициент активности. Концентрационная зависимость активности, построенная при заданной температуре в координатах а-N, носит название диаграммы активности. Известны экспериментально построенные диаграммы активности для ряда двойных систем[3][4][5].
Коэффициент активности в общем случае может быть как больше, так и меньше единицы (при этом говорят о положительных или отрицательных отклонениях от идеального поведения соответственно, или о положительных и отрицательных отклонениях от закона Рауля). Возможны и знакопеременные отклонения от идеального поведения в одной диаграмме (с изменением в пределах от 0,01 и менее до 10 и более, что отражает сложных характер взаимодействия компонентов в системе). Например, для железа в системе Fe-S при 1300 °C коэффициенты активности изменяется от 0,004 при =0,48 до 1,47 при =0,68[6]. В некоторых системах концентрационная зависимость активности является причиной существования стабильного состава, по достижении которого состав испаряющейся жидкости не меняется[7].
Важно отметить, что величина активности и коэффициента активности может быть различной в зависимости от выбора стандартного состояния.
Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом:

где cB — молярные концентрации отдельных ионов (моль/л), zB заряды ионов
Суммирование проводится по всем типам ионов, присутствующих в растворе. Если в растворе присутствуют два или несколько электролитов, то вычисляется общая суммарная ионная сила раствора.
Например, для раствора NaCl с концентрацией 0,001 моль/л, в котором присутствуют два вида однозарядных ионов Na+ и Cl− с концентрациями также равными 0,001 моль/л, ионная сила будет вычисляться следующим образом:
I(NaCl) = 0,5(z²(Na+)•c(Na+) + z²(Cl−)•c(Cl−)) = 0,5(1²•c(NaCl) + (-1)²•c(NaCl)) = c(NaCl)
И ионная сила соответственно будет равна концентрации раствора:
I = 0.5(1²•0,001 моль/л + (-1)²•0,001 моль/л) = 0.5(0,001 моль/л + 0,001 моль/л) = 0,001 моль/л
Это верно для раствора любого сильного электролита, состоящего из однозарядных ионов. Для электролитов, в которых присутствуют многозарядные ионы, ионная сила обычно превышает молярность раствора.
Ионная сила раствора имеет большое значение в теории сильных электролитов Дебая — Хюккеля. Основное уравнение этой теории (предельный закон Дебая — Хюккеля) показывает связь между коэффициентом активности иона ze и ионной силы раствора I в виде:

где γ — коэффициент активности, А — постоянная, не зависящая от заряда иона и ионной силы раствора, но зависящая от диэлектрической постоянной растворителя и температуры.
35. Теории кислот и оснований — совокупность фундаментальных физико-химических представлений, описывающих природу и свойства кислот и оснований. Все они вводят определения кислот и оснований -- двух классов веществ, реагирующих между собой. Задача теории -- предсказание продуктов реакции между кислотой и основанием и возможности её протекания, для чего используются количественные характеристики силы кислоты и основания. Различия между теориями лежат в определениями кислот и оснований, характеристики их силы и, как следствие -- в правилах предсказания продуктов реакции между ними. Все они имеют свою область применимости, каковые области частично пересекаются.
Кислотно-основные взаимодействия чрезвычайно распространенены в природе и находят широкое применение в научной и производственной практике. Теоретические представления о кислотах и основаниях имеют важное значение в формировании всех концептуальных систем химии и оказывают разностороннее влияние на развитие многих теоретических концепций во всех основных химических дисциплинах.
На основе современной теории кислот и оснований разработаны такие разделы химических наук, как химия водных и неводных растворов электролитов, рН-метрия в неводных средах, гомо- и гетерогенный кислотно-основный катализ, теория функций кислотности и многие другие.
. Сила кислоты – характеристика кислоты, показывающая, насколько легко кислота отдает протоны молекулам данного растворителя.
Сила основания – характеристика основания, показывающая, насколько прочно основание связывает протоны, оторванные от молекул данного растворителя.
36. Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксила OH− в воде или в водных растворах, константа автопротолиза воды.
Водоро́дный показа́тель, pH (произносится «пэ аш», английское произношение англ. pH — piː'eɪtʃ «Пи эйч») — мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр:
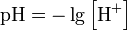
Кислотно-основные индикаторы — органические соединения, способные изменять цвет в растворе при изменении кислотности (pH). Индикаторы широко используют в титровании в аналитической химии и биохимии. Их преимуществом является дешевизна, быстрота и наглядность исследования. Однако из-за субъективности определения цвета и невысокой точности индикаторы pH не всегда удобны; поэтому для точного измерения pH используют pH-метры с цифровой индикацией.
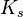
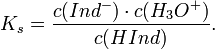
концентрации к.-л. компонента в р-ре. Указывают на определенное состояние системы или на момент достижения этого состояния. Различают индикаторы обратимые и необратимые. Изменение окраски первых при изменении состояния системы (напр., фенолфталеина при изменении рН среды) м. б. повторено многократно. Необратимые индикаторы подвергаются необратимым хим. превращениям, напр., азосоединения при окислении ионами BrO3- разрушаются. Индикаторы, к-рые вводят в исследуемый р-р, наз. внутренними, в отличие от внешних, р-цию с к-рыми проводят вне анализируемой смеси. В последнем случае одну или неск. капель анализируемого р-ра помещают на бумажку, пропитанную индикатором, или смешивают их на белой фарфоровой пластинке с каплей индикатора. Индикаторы применяют чаще всего для установления конца к.-л. хим. р-ции, гл. обр. конечной точки титрования (к. т. т.). В соответствии с титриметрич. методами различают кислотно-основные, адсорбц., окислит.-восстановит. и комплексонометрич. индикаторы. Кислотно-основные индикаторы представляют собой р-римые орг соед., к-рые меняют свой цвет или люминесценцию в зависимости от концентрации ионов Н+ (рН среды). Примен. для установления конца р-ции между к-тами и основаниями (в т. ч. при кислотно-основном титровании) или др. р-ций, если в них участвуют ионы Н+, а также для колориметрич. определения рН водных р-ров. Наиб. важные кислотно-основные индикаторы приведены в табл. 1. Причина изменения цвета индикаторов в том, что присоединение или отдача протонов его молекулами связаны с заменой одних хромофорных групп другими или с появлением новых хромофорных групп. Если индикатор слабая к-та HIn, то в водном р-ре имеет место равновесие: HIn + Н2О D In- + Н3О+. Если индикатор - слабое основание In, то: In + H2O D HIn+ + ОН-. В общем виде можно записать: Ina + Н2О D Inb + Н3О+, где Ina и Inb - соотв. кислая и основная формы индикатора, к-рые окрашены различно. Константа равновесия этого процесса Кln = [Inb][H3O+]/[Ina] наз. константой индикатора. Цвет р-ра зависит от соотношения [Ina]/[Inb], к-рое определяется рН р-ра.
37. Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц.
Гидролиз, дословно, - это разложение водой. Давая такое определение реакции гидролиза солей, мы подчеркиваем, что соли в растворе находятся в виде ионов, и что движущей силой реакции является образование малодиссоциирующих частиц (общее правило для многих реакций в растворах).
Всегда ли ионы способны образовывать с водой малодиссоциирующие частицы? Разбирая этот вопрос с учениками, отмечаем, что катионы сильного основания и анионы сильной кислоты таких частиц образовать не могут, следовательно, в реакцию гидролиза не вступают.
Какие типы гидролиза возможны? Поскольку соль состоит из катиона и аниона, то возможно три типа гидролиза:
-гидролиз по катиону (в реакцию с водой вступает только катион);
гидролиз по аниону (в реакцию с водой вступает только анион);
-совместный гидролиз (в реакцию с водой вступает и катион, и анион);
Гидролиз по катиону - гидролиз соли образованной катионом слабого основания и анионом сильной кислоты. В результате гидролиза по катиону будет происходить подкисление среды (pH < 7). Лакмус изменяет цвет на красный, фенолфталеин не изменяет цвет.
Примеры гидролиза по катиону:
1. Гидролиз CuCl2
Первая ступень:
в молекулярной форме: CuCl2 + Н2О <=> CuOHCl + HCl
в полной ионной форме: Cu2+ + 2Cl- + Н2О <=> CuOH+ + 2Cl- + H+
в сокращенной ионной форме: Cu2+ + Н2О <=> CuOH+ + H+
Вторая ступень:
в молекулярной форме: CuOHCl + Н2О <=> Cu(OH)2 + HCl
в полной ионной форме: CuOH+ + Cl- + Н2О <=> Cu(OH)2 + H+ + Cl-
в сокращенной ионной форме: CuOH+ + Н2О <=> Cu(OH)2 + H+
Гидролиз по аниону - гидролиз соли образованной катионом сильного основания и анионом слабой кислоты. В результате гидролиза по аниону будет происходить подщелачивание среды (pH > 7). Лакмус изменяет цвет на синий, фенолфталеин на красный.
Примеры гидролиза по аниону:
1. Гидролиз Na2CO3
Первая ступень:
в молекулярной форме: Na2CO3 + H2O <=> NaHCO3 + NaOH
в полной ионной форме: 2Na+ + CO32- + H2O <=> 2Na+ + HCO3- + OH-
в сокращенной ионной форме: CO32- + H2O <=> HCO3- + OH-
Вторая ступень:
в молекулярной форме: NaHCO3 + H2O <=> H2CO3 + NaOH
в полной ионной форме: Na+ + HCO3- + H2O <=> Na+ + H2CO3 + OH-
в сокращенной ионной форме: HCO3- + H2O <=> H2CO3 + OH
Гидролиз соли слабой кислоты и слабого основания:
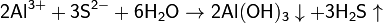
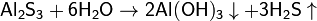
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
Степень гидролиза
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр);
α = (cгидр/cобщ)·100 %
где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов.
В качестве примера ниже приводится вывод уравнения константы гидролиза соли, образованной слабой кислотой и сильным основанием:
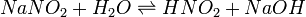

Уравнение константы равновесия для данной реакции имеет вид:
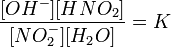 или
или 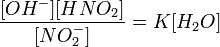
Так как концентрация молекул воды в растворе постоянна, то произведение двух постоянных можно заменить одной новой — константой гидролиза:

Численное значение константы гидролиза получим, используя ионное произведение воды и константу диссоциации азотистой кислоты:
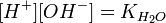
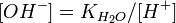
подставим в уравнение константы гидролиза равна:
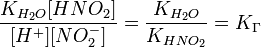
В общем случае для соли, образованной слабой кислотой и сильным основанием:
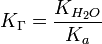
, где — константа диссоциации слабой кислоты, образующейся при гидролизе для соли, образованной сильной кислотой и слабым основанием:

, где — константа диссоциации слабого основания, образующегося при гидролизе
для соли, образованной слабой кислотой и слабым основанием:
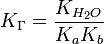
38. Буферные растворы (англ. buffer, от buff — смягчать удар) — растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты и её соли (напр., СН3СООН и CH3COONa) или слабого основания и его соли (напр., NH3 и NH4CI). Величина рН буферного раствора мало изменяется при добавлении небольших количеств свободной сильной кислоты или щёлочи, при разбавлении или концентрировании. Буферные растворы широко используют в различных химических исследованиях.
Буферные растворы имеют большое значение для протекания процессов в живых организмах. Например, в крови постоянство водородного показателя рН поддерживается буферными смесями, состоящими из карбонатов и фосфатов. Известно большое число буферных растворов (ацетатно-аммиачный буферный раствор, фосфатный буферный раствор, боратный буферный раствор, формиатный буферный раствор и др.).
Значение pH буферного раствора можно рассчитать по формуле: 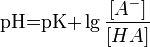 , где это отрицательный десятичный логарифм от константы диссоциации кислоты.
, где это отрицательный десятичный логарифм от константы диссоциации кислоты.
3-[N-Морфолино]пропансульфоновая кислота (MOPS) — химическое соединение, наиболее часто используемое для приготовления буферных систем в биологии и биохимии. Обладая показателем константы диссоциации, pKa равным 7,20, MOPS является прекрасным буфером для множества биологических систем с pH, близким к нейтральному. Проверено и рекомендовано использование MOPS для электрофореза в полиакриламидном геле (ПААГ). Не рекомендуется использование более 20 mM для работы с клеточными культурами млекопитающих.
Калий-фосфатный буфер (фосфатный буфер) — буферный раствор, широко используемый в биохимии и молекулярной биологии. Для приготовления фосфатного буфера используют гидрофосфат и дигидрофосфаты калия. Так как фосфорная кислота имеет несколько констант диссоциации, возможно приготовление фосфатного буфера со значениями рН от 6 до 8, наиболее распространенным является фосфатный буфер с рН около 7.
Натрий-фосфатный буфер (англ. Phosphate buffered saline, PBS) — буферный раствор, используемый в биологических исследованиях. Представляет собой водный раствор солей, содержащий хлорид натрия, фосфат натрия, хлорид калия и фосфат калия. Осмолярность и концентрации ионов в растворе обычно соответствуют концентрациям в теле человека (то есть данный буферный раствор является изотоническим).
Натрий-ацетатный буфер (ацетатный буфер) — буферный раствор, содержащий ацетат натрия и уксусную кислоту. Значение pK ацетатного буфера составляет около 4,75, поэтому применение находят буферы со значениями рН от 3 до 6.
Для приготовления буфера используют тригидрат ацетата натрия (136,09 г/моль) и раствор уксусной кислоты (например, 0,2 М раствор, который содержит 27,22 г/л уксусной кислоты).
Натрий-ацетатный буфер используют в биохимии для растворения белков, при хроматографии, при осаждении ДНК для повышения ионной силы раствора.
39. Буферная ёмкость раствора (от англ. buffer — амортизатор, англ. buff — смягчать толчки) — такое количество кислоты или основания, нужное для изменения pH буферного раствора ровно на 1.
40. Окисли́тельно-восстанови́тельные реа́кции, ОВР, редокс (от англ. redox ← reduction-oxidation — окисление-восстановление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.






