Пример 1. Напишите формулу мицеллы золя иодида серебра, полученного при взаимодействии разбавленного раствора иодида калия и избытка нитрата серебра. Какой заряд будет иметь гранула?
Решение: KI + AgNO3  AgI
AgI 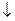 + KNO3
+ KNO3
AgI ядро мицеллы. Потенциал‑определяющий слой составят ионы вещества, находящегося в избытке (AgNO3)
AgNO3  Ag+ + NO
Ag+ + NO 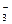
А именно те ионы, которые имеют большее химическое сродство к веществу, образующим ядра, т. е ионы Ag+. Следовательно NO 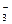 ‑ противоионы, они образуют адсорбционный и диффузионный слой. Следовательно формула золя иодида серебра будет
‑ противоионы, они образуют адсорбционный и диффузионный слой. Следовательно формула золя иодида серебра будет
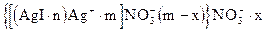
гранула
Заряд гранулы обуславливается потенциал‑определяющими ионами (Ag+). Следовательно он будет положительным.
Укрупнение частиц коллоидной системы за счет их слипания под влиянием молекулярных сил притяжения, называется коагуляцией. Коагуляция может наступить под действием различных факторов, но наибольший интерес представляет коагуляция под действием электролитов. Коагуляцию золей вызывает лишь тот ион электролита, который имеет заряд, противоположный заряду гранулы.
Чтобы вызвать коагуляцию золя, необходимо концентрацию прилитого электролита в золе довести до определенной величины. Та минимальная молярная концентрация эквивалента прилитого к золю электролита, при которой начинается коагуляция золя объемом 1 м3, называется порогом коагуляции:
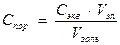 , (3)
, (3)
где Спор – порог коагуляции, моль/м3;
Сэкв – молярная концентрация эквивалента электролита, моль/м3;
Vэл – объем прилитого электролита, м3;
V золь – объем коагулирующего золя, м3.
Величина, обратная порогу коагуляции, называется коагулирующей способностью электролита (точнее, коагулирующего иона).
При экспериментальном изучении коагуляции золей электролитами было установлено правило Шульце – Гарди (правило значности): с повышением заряда (валентности) коагулирующего иона его коагулирующая способность повышается.
Пример 2. Для коагуляции 10 мл золя иодида серебра потребовалось 4,5 мл раствора нитрата бария молярной концентрации 0,05 моль/л. Определить порог коагуляции электролита.
Решение. Порог коагуляции рассчитываем по уравнению в единицах СИ, поэтому предварительно сделаем пересчет молярной концентрации нитрата бария в молярную концентрацию эквивалента этого электролита, а миллиметры в кубические метры:
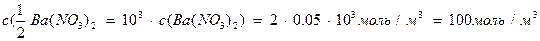
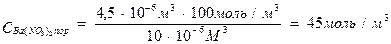 .
.
Пример 3. Для коагуляции 10 мл золя иодида серебра требуется 0,5 мл раствора нитрата кальция молярной концентрации эквивалента 0,2 моль/л или 0,2 мл раствора нитрата алюминия молярной концентрации эквивалента 0,03 моль/л или 1,5 мл раствора нитрата калия молярной концентрации 1 моль/л. Определите: а) пороги коагуляции, б) заряд частиц золя, в) отношение коагулирующей способности ионов.
Решение. Пороги коагуляции определяем по уравнению 3:
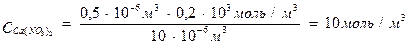


разница в порогах коагуляции велика. Если же принять во внимание, что анион во всех электролитах один и тот же, то столь большая разница может быть связана только с коагулирующей способностью катионов. Они разные не только по своей природе, но и по валентности. Следовательно, гранулы несут отрицательный заряд.
Отношение коагулирующей способности катионов будет:
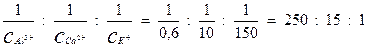
Последнее отношение получается, если коагулирующую способность иона калия принять за единицу. Отсюда следует, что коагулирующая способность ионов кальция в 15 раз, а ионов алюминия в 250 раз выше, чем ионов калия.
ПОКАЗАТЕЛИ КАЧЕСТВА ВОДЫ






