Пример 1. Произведение растворимости (ПР) оксалата бария BaC2O4 равно 1,62  10-7. Вычислите растворимость оксалата бария в воде.
10-7. Вычислите растворимость оксалата бария в воде.
Решение. В растворе труднорастворимого сильного электролита BaC2O4 существует равновесие:
BaC2O4 = Ва2+ + (С2О4)2–
в осадке в растворе
ПР BaC2O4=[Ва2+] [C2O4 2–],
т. к. оксалат бария диссоциирует на два иона, то концентрация его в растворе равна концентрации каждого из ионов т.е.
С 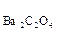 = С
= С  = С
= С  =
= 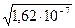 =0,4
=0,4 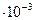 (моль/л), т.е. растворимость оксалата бария в воде при температуре 20 0С равна 0,4
(моль/л), т.е. растворимость оксалата бария в воде при температуре 20 0С равна 0,4 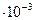 моль/л
моль/л
Пример 2. Растворимость фосфата серебра Ag3PO4 в воде при температуре 20 0С равна 6,15  10 –3 г/л. Определить ПР.
10 –3 г/л. Определить ПР.
Решение. Молярная масса Ag3PO4=418,58 г/моль следовательно раствор содержит 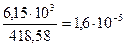 моль/л Эту величину называют молярной растворимостью. При диссоциации Ag3PO4 образуется три иона Ag+ и один ион (PO4)3-, поэтому концентрации ионов в растворе соответственно равны: С
моль/л Эту величину называют молярной растворимостью. При диссоциации Ag3PO4 образуется три иона Ag+ и один ион (PO4)3-, поэтому концентрации ионов в растворе соответственно равны: С 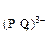 = 1,6
= 1,6  10 –5 моль/л
10 –5 моль/л
С  = 3
= 3 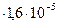 моль/л произведение растворимости Ag3PO4 равно
моль/л произведение растворимости Ag3PO4 равно
ПР 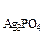 =С
=С 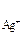
 С
С 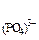 =(4,8
=(4,8  10 –5)3
10 –5)3  (1,6
(1,6  10 –5)=1,77
10 –5)=1,77  10 –18
10 –18
Пример 3. Произведение растворимости MgS при температуре 25 0С равно 2,0  10-15. Образуется ли осадок сульфида магния при смешивании равных объемов 0,004 н. раствора нитрата магния и 0,0006 н. сульфида натрия. Степень диссоциации этих электролитов принята за 1.
10-15. Образуется ли осадок сульфида магния при смешивании равных объемов 0,004 н. раствора нитрата магния и 0,0006 н. сульфида натрия. Степень диссоциации этих электролитов принята за 1.
Решение. При смешивании равных объемов растворов объем смеси стал в два раза больше объема каждого из взятых растворов. Следовательно концентрация взятых веществ уменьшилась вдвое, т.е.
С(Mg(NO3)2=  н. С(Na2S)=
н. С(Na2S)=  н. Для определения концентрации ионов Mg2+ и S2 – необходимо выразить концентрации растворов в моль/л т.е. С(Mg(NO3)2=0,002 н=0,001 М
н. Для определения концентрации ионов Mg2+ и S2 – необходимо выразить концентрации растворов в моль/л т.е. С(Mg(NO3)2=0,002 н=0,001 М
С(Mg2+)=1  10 –3 моль/л
10 –3 моль/л
С(Na2S)=0,0003 н. 0,00015 М
С(S2 –)=1,5  10 –4 моль/л
10 –4 моль/л
Отсюда произведение концентраций ионов в растворе
С(Mg2+)  С(S2 –)=1
С(S2 –)=1  10 –3
10 –3  1,5
1,5  10 –4 = 1,5
10 –4 = 1,5  10 –7
10 –7
Эта величина больше ПР, следовательно, осадок образуется.
2.3. Определение коэффициента растворимости соли
Пример 1. При 60 0С насыщенный раствор KNO3 содержит 52,4% (масс) соли. Найти коэффициент растворимости соли при этой температуре.
Решение. Коэффициент растворимости ‑ это масса вещества, растворившегося при одинаковых условиях в 100 г растворителя с образованием насыщенного раствора. Находим коэффициент растворимости из пропорции:
на 47,6 г Н2О приходится 52,4 г KNO3
на 100 г Н2О приходится х г KNO3
х = 100  52,4 / 47,6 = 110 (г)
52,4 / 47,6 = 110 (г)
Таким образом коэффициент растворимости KNO3 при 60 0С равен 110 г.
Пример 2. При охлаждении 300 г 15% ‑ ного раствора часть растворенного вещества выпала в осадок и концентрация раствора стала 8%. Чему равна масса выпавшего в осадок вещества?
Решение. В 300 г 15% ‑ ного раствора содержится 45 г растворенного вещества и 255 г растворителя. При охлаждении количество растворителя не изменилось. Содержание растворенного вещества в 255 г растворителя находим из пропорции:
92 г растворителя содержат 8 г вещества
255 г растворителя содержат х г вещества
х = 8  255/92 = 22,2 г
255/92 = 22,2 г
Таким образом при охлаждении раствора в осадок выпало 45‑22,2 = 22,8 г растворенного вещества.
Пример 3. Коэффициент абсорбции кислорода и азота при 0 0С равны соответственно 0,049 и 0,23. Газовую смесь, содержащую 20% (об) О2 и 80% (об) N2 взболтали с водой при 0 0С до получения насыщенного раствора. Найти процентное соотношение (по объему) растворенных в воде газов.
Решение. Коэффициент абсорбции это объем газа, растворяющегося в одном объеме растворителя с образованием насыщенного раствора. Из закона Генри следует, что объем растворяющегося газа (значит и коэффициент абсорбции) при данной температуре не зависит от парциального давления газа. По условию задачи в 1 л воды растворяется 49 мл О2 и 23 мл N2. Однако непосредственно сравнить эти объемы нельзя, так как парциальное давление растворенных газов различны и составляют соответственно 0,2 и 0,6 от общего давления газовой смеси. Если принять последнее за 1, то объемы растворенных кислорода и азота, приведенные к этому давлению, будут равны 49  0,2=9,8 мл и 23
0,2=9,8 мл и 23  0,8=18,4 мл общий объем растворенных газов составит, следовательно, 9,81+18,4=28,2 мл. Находим процентное содержание каждого газа: 9,8
0,8=18,4 мл общий объем растворенных газов составит, следовательно, 9,81+18,4=28,2 мл. Находим процентное содержание каждого газа: 9,8  100/28,2=35% (об)
100/28,2=35% (об)
18,4  100/28,2 = 65% (об)
100/28,2 = 65% (об)






