Окислительно-восстановительными называют реакции, сопровождающиеся изменением степени окисления атомов, входящих в состав реагирующих веществ. Под степенью окисления (п) понимают условный заряд атома, который вычисляют исходя из предположения, что молекула состоит только из ионов. Иными словами: степень окисления — это условный заряд, который приобрел бы атом элемента, если предположить, что они принял или отдал то или иное число электронов.
Окисление-восстановление — это единый, взаимосвязанный процесс. Окисление приводит к повышению степени окисления восстановителя, а восстановление — к ее понижению у окислителя.
Повышение или понижение степени окисления атомов отражается в электронных уравнениях: окислитель принимает электроны, а восстановитель их отдает. При этом не имеет значения, переходят ли электроны от одного атома к другому полностью и образуются ионные связи или электроны только оттягиваются к более электроотрицательному атому и возникает полярная связь. О способности того или иного вещества проявлять окислительные, восстановительные или двойственные (как окислительные, так и восстановительные) свойства можно судить по степени окисления атомов окислителя и восстановителя.
Атом того или иного элемента в своей высшей степени окисления не может ее повысить (отдать электроны) и проявляет только окислительные свойства, а в своей низшей степени окисления не может ее понизить (принять электроны) и проявляет только восстановительные свойства. Атом же элемента, имеющий промежуточную степень окисления, может проявлять как окислительные, так и восстановительные свойства. Например:
| N5+(HNO3) | S6+(H2SO4) | Проявляют только окислительные свойства |
| N4+(NO2) | S4+(SO2) | Проявляют окислительные и восстановительные свойства |
| N3+(NH2) | ||
| N2+(NO) | S2+(SO) | |
| N+(N2O) | ||
| N0(N2) | S0(S2; S8) | |
| N-(NH2OH) | S-1(H2S2) | |
| N2-(N2H4) | ||
| N3-(NH3) | S2-(H2S) | Проявляют только восстановительные свойства |
При окислительно-восстановительных реакциях валентность атомов может и не меняться. Например, в окислительно-восстановительной реакции Н°2+С1°2=Н+Сl- валентность атомов водорода и хлора до и после реакции равна единице. Изменилась их степень окисления. Валентность определяет число связей, образованных данным атомом, и поэтому знака заряда не имеет. Степень же окисления имеет знак плюс или минус.
Пример 1. Исходя из степени окисления (п) азота, серы и марганца в соединениях NH3, HNO2, HNO3, H2S, H2SO3, H2SO4, MnO2 и KMnO4, определите, какие из них могут быть только восстановителями, только окислителями и какие проявляют как окислительные, так и восстановительные свойства.
Решение. Степень окисления азота в указанных соединениях соответственно равна: -3 (низшая), +3 (промежуточная), +5 (высшая); n(S) соответственно равна: -2 (низшая), +4 (промежуточная), +6 (высшая); n(Мn) соответственно равна: + 4 (промежуточная), +7 (высшая). Отсюда: NH3, H2S — только восстановители; HNO3, H2SO4, КМnОд — только окислители; HNO2, H2SO3, MnO2 — окислители и восстановители.
Пример 2. Могут ли происходит окислительно-восстановительные реакции между следующими веществами: a) H2S и HI; б) H2S и H2SO3; в) H2SO3 и НС1О4?
Решение: а) степень окисления в H2S w(S) = -2; в HI и(1) = -1. Так как и сера, и иод находятся в своей низшей степени окисления, то оба вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут;
б) в H2S n(S) = -2 (низшая), в H2SO3 n(S) = +4 (промежуточная);
Следовательно, взаимодействие этих веществ возможно, причем H2SO3 является окислителем;
в) в H2SO3 n(S) = +4 (промежуточная); в НС1О4 n(С1) = +7 (высшая). Взятые вещества могут взаимодействовать, H2SO3 в этом случае будет проявлять восстановительные свойства.
Пример 3. Составьте уравнения окислительно-восстановительной реакции, идущей по схеме:
+7 +3 +2 +5
KMnO4+H3PO3+H2SO4→MnSO4+ Н3РО4+ K2SO4 + Н2О
Решение. Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях:
восстановитель 5 Р3+ — 2е- = Р5+ процесс окисления
окислитель 2 Мn7+ + 5е-= Мn2+ процесс восстановления
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Уравнение реакции будет иметь вид:
2КМпО4 + 5Н3РО3 + 3H2SO4 = 2MnSO4 + 5Н3РО4 + K2SO4 + ЗН2О
Пример 4. Составьте уравнение реакции взаимодействия цинка с концентрированной серной кислотой, учитывая максимальное восстановление последней.
Решение. Цинк, как любой металл, проявляет только восстановительные свойства. В концентрированной серной кислоте окислительная функция принадлежит сере (+6). Максимальное восстановление серы означает, что она приобретает минимальную степень окисления. Минимальная степень окисления серы как p -элемента VIA-группы равна -2. Цинк как металл IIВ-группы имеет постоянную степень окисления +2. Отражаем сказанное в электронных уравнениях:
восстановитель Zn — 2e - = Zn2+ процесс окисления
окислитель S6+ + 8е- = S2-процесс восстановления
Составляем уравнение реакции:
4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O
Перед H2SO4 стоит коэффициент 5, а не 1, ибо четыремолекулы H2SO4 идут на связывание четырех ионов Zn2+.
Пример 5. Определение направления окислительно‑восстановительной реакции по величине окислительно‑восстановительного потенциала. Возможно ли в качестве окислителя в кислой среде использовать K2Cr2O7 в следующих процессах при стандартных условиях:
а) 2 F– –2 e–  F
F 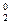
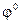 = + 2,85 В;
= + 2,85 В;
б) 2 Cl– – 2 e–  Cl2
Cl2 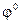 = + 1,36 В;
= + 1,36 В;
в) 2 Br–– 2 e–  Br2
Br2 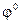 = + 1,06 В;
= + 1,06 В;
г) 2 I––2 e–  I2
I2 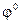 = + 0,54 В.
= + 0,54 В.
Стандартный окислительно‑восстановительный потенциал системы: 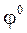
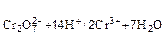 =1,33 В.
=1,33 В.
Решение: Для определения направления окислительно ‑ восстановительной реакции необходимо определить ЭДС:
ЭДС = 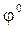 окисл. –
окисл. – 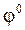 восстанов.
восстанов.
где 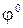 окисл ‑ потенциал окислителя;
окисл ‑ потенциал окислителя;
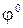 восстанов ‑ потенциал восстановителя.
восстанов ‑ потенциал восстановителя.
Реакция возможна, если ЭДС 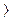 0. Для выяснения возможности протекания окислительно‑восстановительных реакций определяем ЭДС следующих систем:
0. Для выяснения возможности протекания окислительно‑восстановительных реакций определяем ЭДС следующих систем:
а) F 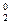 / 2F– II (Cr2O7)2–+ 14 H+ / 2 Cr3+ + 7 H2O
/ 2F– II (Cr2O7)2–+ 14 H+ / 2 Cr3+ + 7 H2O
ЭДС = 1,33 – 2,85 = –1,52 В;
б) Cl2/ 2 Cl– II (Cr2O7)–2 + 14 H+ / 2 Cr3+ + 7 H2O
ЭДС = 1,33 –1,36 = – 0,03 B;
в) Br2 / 2 Br– II(Cr2O7)2– + 14 H+ / 2 Cr3+ + 7 H2O
ЭДС = 1,33 –1,06 = + 0,27 B;
г) I2 / 2 I– II(Cr2O7)2– + 14 H+ / 2 Cr3+ + 7 H2O
ЭДС = 1,33 –0,54 = + 0,79 B.
Таким образом, дихромат калия K2Cr2O7 может быть использован в качестве окислителя только для процессов:
2 Br– ‑ 2 e–  Br
Br 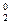

2 I – ‑ 2 e–  I
I 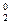
Пример 6. Определение возможности протекания окислительно-восстановительной реакции по величине изменения энергии Гиббса (изобарно-изотермического потенциала). В каком направлении будет протекать реакция?
2 NO2 (г) + H2O (ж) = 2 HNO3 (аq) + NO (г).
Если стандартные значения энергии Гиббса равны:
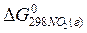 = 51,84 кДж/моль;
= 51,84 кДж/моль;
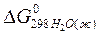 = –237,5 кДж/моль;
= –237,5 кДж/моль;
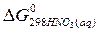 = –79,91 кДж/моль;
= –79,91 кДж/моль;
 = + 86,69 кДж/моль.
= + 86,69 кДж/моль.
Решение. Определяем 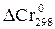 процесса
процесса
3 NO3 (г) + H2Oж = 2 HNO2 ( ) + NO (г);
) + NO (г);
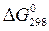 =2
=2 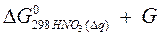
 -3
-3  –
– 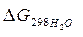 =2(–79,91) + 86,69 – 3(51,84) – (–237,5) = = 8,65 кДж
=2(–79,91) + 86,69 – 3(51,84) – (–237,5) = = 8,65 кДж
Ответ: протекание реакции возможно только в обратном направлении, так как ΔGr >0.
Пример 7. Определение окислительно-восстановительного потенциала Еh и окислительно-восстановительного показателя (rH2). Рассчитать Еh и rH2 воды реки, если рН ее 7,8, а коэффициент насыщения воды кислородом равен 90% Е0=0,779 В.
Решение. 1. Находим концентрацию растворенного кислоррода для температуры 25 0С, т.к. в формуле Еh все коэффициенты приведенф к таким условиям р0=8,28  0,9=7,45 мг/л
0,9=7,45 мг/л
2. Подствляем числовые значения в формулу:
Еh = Е0 –0,058 рН + 0,0145
Еh = 0,779 – 0,058  7,8 + 0,0145 lg7,45 = 0,339 В
7,8 + 0,0145 lg7,45 = 0,339 В
3. Находим rH2 = 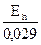 +2рН =
+2рН = 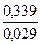 +2
+2  7,8 = 27,3
7,8 = 27,3
При равенстве молекулярных концентраций кислорода и водорода  28. Отклонения rH2 от 28 в меньшую сторону указывает на преимущественное протекание восстановительных процессов в водоеме и наоборот.
28. Отклонения rH2 от 28 в меньшую сторону указывает на преимущественное протекание восстановительных процессов в водоеме и наоборот.






