Концентрацией раствора называется содержание растворенного вещества в определенной массе или известном объеме раствора или растворителя.
Пример 1. Вычислите: а) массовую (процентную) (с,%); б) молярную концентрацию (см); молярную концентрацию эквивалента (сн); г) молярную (см) концентрацию раствора Н3РО4, полученного при растворении 18 г кислоты в 282 см3 воды, если плотность его 1,031г/см3. Чему равен титр (Т) этого раствора?
Решение: а) Массовая концентрация показывает число граммов (единиц массы) вещества, содержащееся в 100 г (единиц массы) раствора. Так как массу 282 см3 воды можно принять равной 282 г, то масса полученного раствора 18 + 282 = 300 г и, следовательно:
300- 18
100- с%
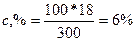 ;
;
б) молярная (мольно-объемная)% концентрация показывает число молей растворенного вещества, содержащихся в 1 л раствора. Масса 1 л раствора 1031 г. Массу кислоты в литре раствора находим из соотношеия
300-18
1031-х
 г.
г.
Молярную концентрацию раствора получим делением числа граммов Н3РО4 в 1 л раствора на молярную массу Н3РО4 (97,99 г/моль):
см = 61,86/97,99 = 0,63 м.(моль/л).
в) молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворенного вещества,содержащихся в 1 л раствора.
Так как эквивалентная масса Н3РО4 = М/ 3 = 97,99/3 = 32,66 г/моль, то
с н = 61,86/32,66= 1,89 н. (моль/л);
г) моляльная концентрация (или моляльность) показывает число молей растворенного вещества, содержащихся в 1000 г растворителя. Массу Н3РО4 в 1000 г растворителя находим из соотношения
282-18,
1000-х
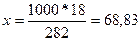 г.
г.
Отсюда см = 63,83/97,99 = 0,65 м. (моль/кг).
Титром раствора называют число граммов растворенного вещества в 1 см3 (мл) раствора. Так как в 1 л раствора содержится 61,8б г кислоты, то Т= 61,86/1000 = 0,06186 г/см3
Зная молярную концентрацию эквивалента и молярную массу эквивалента (тэ) растворенного вещества, титр легко найти по формуле
Т=снmэ/1000.
Пример 2. На нейтрализацию 50 см3 раствора кислоты израсходовано 25 см3' 0,5 н. раствора щелочи. Чему равна молярная концентрация эквивалентов кислоты?
Решение. Так как вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы равной молярной концентрации эквивалентов реагируют в равных объемах. При разных молярных концентрациях эквивалентов объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т.е.
V1:V2 = 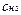 :
: 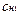 или V1с
или V1с  =V2*с
=V2*с 
50с  = 25 * 0,5 откуда с
= 25 * 0,5 откуда с  = 25 * 0,5 / 50 = 0,25н. (моль/л).
= 25 * 0,5 / 50 = 0,25н. (моль/л).
Пример 3. К 1 л 10%-ного раствора КОН (пл. 1,092 г/см3) прибавили 0,5 л 5%-ного раствора КОН (пл. 1,045 г/см3). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора.
Решение. Масса одного литра 10%-ного раствора КОН равна 1092 г. В этом растворе содержится 1092 *10/100 = 109,2 г КОН. Масса 0,5 л 5%-ного раствора 1045 • 0,5 = 522,5 г. В этом растворе содержится 522,5 * 5/100 = 26,125 г КОН.
В общем объеме полученного раствора (2 л) содержание КОН составляет 109,2+26,125=135,325г. Отсюда молярная концентрация раствора см= 135,325/(2*56,1) = 1,2 М, где 56,1 г/моль — молярная масса КОН.
Пример 4. Какой объем 96%-ной кислоты плотностью 1,84 г/см3 потребуется для приготовления 3 л 0,4 н. раствора?
Решение. Эквивалентная масса H2SO4 = М/2 = 98,08/2 = 49,04 г/моль. Для приготовления 3 л 0,4 н. раствора требуется 49,04 *0,4 *3= = 58,848 г H2SO4. Масса 1 см3 96%-ной кислоты 1,84 г. В этом растворе содержится 1,84 * 96/100 = 1,766 г H2SO4. Следовательно, для приготовления 3 л 0,4 н. раствора надо взять 58,848: 1,766 = 33,32 см3 этой кислоты.
Свойства растворов
Пример 1. Вычислите температуры кристаллизации и кипения 2%-ного водного раствора глюкозы.
Решение. По закону Рауля понижение температуры кристаллизации и повышение температуры кипения раствора (∆Т) по сравнению с температурами кристаллизации и кипения растворителя выражаются уравнением
 , (1)
, (1)
где К — криоскопическая или эбулиоскопическая константа. Для воды они соответственно равны 1,86 и 0,52°; т и М — соответственно масса растворенного вещества и его молярная масса; т1 — масса растворителя.
Понижение температуры кристаллизации 2%-ного раствора С6Н12О6 находим по формуле (1):

Вода кристаллизуется при 0 С, следовательно, температура кристаллизации раствора 0 - 0,21 = - 0,21 С.
По формуле (1) находим и повышение температуры кипения-2%-ного раствора:

Вода кипит при 100°С, следовательно, температура кипения этого раствора 100 + 0,06 = 100,06°С.
Пример 2. Раствор, содержащий 1,22 г бензойной кислоты С6Н5СООН в 100 г сероуглерода, кипит при 46,529°С. Температура кипения сероуглерода 46,3°С. Вычислите эбулиоскопическую константу сероуглерода.
Решение. Повышение температуры кипения ΔТ = 46,529 - 46,3 = = 0,229°. Молярная масса бензойной кислоты 122 г/моль. По формуле (1) находим эбулиоскопическую константу:

Пример 3. Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при -0,279°С. Вычислите молярную массу глицерина.
Решение. Температура кристаллизации чистой воды 0 0С, следовательно, понижение температуры кристаллизации ∆Т=0-(-0,279)=0,2790С. Масса глицерина т (г), приходящаяся на 1000 г воды, равна:
 г.
г.
Подставляя в уравнение
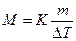 (2)
(2)
числовые значения, вычисляем молярную массу глицерина:

Пример 4. Вычислите массовую долю (%) водного раствора мочевины (NH2)2CO, зная, что температура кристаллизации этого раствора равна -0,4650С.
Решение: Температура кристаллизации чистой воды 00С, следовательно ∆Т=0–(-0,465)= +0,4650. Молярная масса мочевины 60 г/моль. Находим массу m (г) растворенного вещества, приходящуюся на 1000г воды, по формуле(2):
 г.
г.
Общая масса раствора, содержащего 15г мочевины, составляет 1000+15=1015г. Процентное содержание мочевины в данном растворе находим из соотношения
В 1015г раствора – 15г вещества
100 г раствора - х г вещества
х = 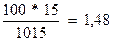 г.
г.
Ответ: 1,48%.






