Несмотря на простоту вывода основного уравнения молекулярно-кинетической теории газов, формулу  не так-то просто проверить на опыте. Да, мы умеем измерять на опыте давление газа, но у нас нет приборов для прямого измерения величины энергии Е = Е 1× n. Человечество вообще не умеет измерять внутреннюю энергию газа в состоянии теплового равновесия. Чтобы реально использовать уравнение кинетической теории газов, приходится прибегать к процедуре косвенных измерений величины Е (энергии). Для этого человечество ввело величину, характеризующую состояние теплового равновесия для любых объектов. Читатель правильно догадался, такой величиной является температура; символ – Т.
не так-то просто проверить на опыте. Да, мы умеем измерять на опыте давление газа, но у нас нет приборов для прямого измерения величины энергии Е = Е 1× n. Человечество вообще не умеет измерять внутреннюю энергию газа в состоянии теплового равновесия. Чтобы реально использовать уравнение кинетической теории газов, приходится прибегать к процедуре косвенных измерений величины Е (энергии). Для этого человечество ввело величину, характеризующую состояние теплового равновесия для любых объектов. Читатель правильно догадался, такой величиной является температура; символ – Т.
Пока будем обходиться понятием эмпирической температуры, т.е. той физической величины, которая измеряется на опыте и связана с интуитивным представлением о тепловом равновесии. Эмпирическая температура объекта – это то, что измеряется другим объектом-термометром, приведённым в состояние теплового равновесия с исходным объектом, и служит характеристикой равновесного состояния. В роли такого объекта-термометра может служить любой объект в состоянии теплового равновесия, характеристики которого реагируют на изменение этого состояния.
Из кинетической теории идеального газа следует, давление пропорционально кинетической энергии молекулы (частицы), если объём V, масса газа m и его сортность m неизменны. Вместе с тем из экспериментальных законов Бойля–Мариотта и Гей-Люссака Клапейрону удалось получить уравнение, связывающее все три термодинамических макропараметра вместе; произведение давления и объёма делённое на температуру остаётся постоянным для любого состояния идеального газа  , если сорность и масса газа не изменяются. Эту формулу русский учёный Д.И. Менделееву в 1875 году обобщил для любой массы газа в виде
, если сорность и масса газа не изменяются. Эту формулу русский учёный Д.И. Менделееву в 1875 году обобщил для любой массы газа в виде  , –– объединённый газовый закон. Отсюда следует, при постоянном объёме и массы газа давление пропорционально температуре. Естественно ожидать, температура системы должна быть пропорциональна энергии частицы. Чтобы найти коэффициент пропорциональности между абсолютной температурой Т и энергией частицы Е 1, сопоставим обобщённое уравнение идеального газа и основное уравнение кинетической теории:
, –– объединённый газовый закон. Отсюда следует, при постоянном объёме и массы газа давление пропорционально температуре. Естественно ожидать, температура системы должна быть пропорциональна энергии частицы. Чтобы найти коэффициент пропорциональности между абсолютной температурой Т и энергией частицы Е 1, сопоставим обобщённое уравнение идеального газа и основное уравнение кинетической теории:
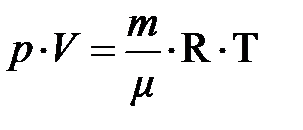
 .
.
Если читатель примет к сведению, что m =  × N,
× N,  , а
, а  и, проявив терпение, проведёт преобразования первого уравнения, то испытает чувство глубокого удовлетворения, поскольку в результате его действий первое уравнение примет вид
и, проявив терпение, проведёт преобразования первого уравнения, то испытает чувство глубокого удовлетворения, поскольку в результате его действий первое уравнение примет вид  . После преобразований левые части уравнений системы равны, должны быть равны и правые. Отсюда немедленно следует, энергия одной молекулы
. После преобразований левые части уравнений системы равны, должны быть равны и правые. Отсюда немедленно следует, энергия одной молекулы  оказывается зависящей лишь от температуры, но не зависит от массы молекулы; буква k, равная
оказывается зависящей лишь от температуры, но не зависит от массы молекулы; буква k, равная  =
=  , называется постоянной Больцмана. Здесь весьма важно обратить внимание на формулу
, называется постоянной Больцмана. Здесь весьма важно обратить внимание на формулу  . Если имеется смесь из нескольких сортов газов, результирующее давление может быть записано
. Если имеется смесь из нескольких сортов газов, результирующее давление может быть записано  ; здесь
; здесь  – концентрация различных сортов газов. Выражение перепишем
– концентрация различных сортов газов. Выражение перепишем  , отсюда немедленно следует закон Дальтона – давление смеси идеальных газов равно сумме парциальных давлений газов, образующих смесь.
, отсюда немедленно следует закон Дальтона – давление смеси идеальных газов равно сумме парциальных давлений газов, образующих смесь.
Следует вернуться к выражению средней энергии молекулы  . При выводе его мы учитывали лишь поступательное движение молекул; здесь «тройка» отражает размерность пространства, в котором происходят рассматриваемые события. Следовательно, на одну степень свободы (возможного направления движения) приходится энергия, равная
. При выводе его мы учитывали лишь поступательное движение молекул; здесь «тройка» отражает размерность пространства, в котором происходят рассматриваемые события. Следовательно, на одну степень свободы (возможного направления движения) приходится энергия, равная 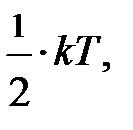 поскольку ни одно из направлений поступательного движения не имеет преимущества. Однако в природе наряду с поступательным движением возможны вращение молекул и колебания атомов в молекуле, входящих в состав молекул. Эти виды движений, также как и поступательное движение, связаны с некоторым запасом энергии, определить который позволяет устанавливаемое статистической физикой положение о равнораспределении энергии по степеням свободы молекул. Если предположить, что ни один из видов движения не имеет преимущества перед другими, то на любую степень свободы поступательного, вращательного и колебательного движений должна приходиться в среднем одинаковая энергия, равная
поскольку ни одно из направлений поступательного движения не имеет преимущества. Однако в природе наряду с поступательным движением возможны вращение молекул и колебания атомов в молекуле, входящих в состав молекул. Эти виды движений, также как и поступательное движение, связаны с некоторым запасом энергии, определить который позволяет устанавливаемое статистической физикой положение о равнораспределении энергии по степеням свободы молекул. Если предположить, что ни один из видов движения не имеет преимущества перед другими, то на любую степень свободы поступательного, вращательного и колебательного движений должна приходиться в среднем одинаковая энергия, равная  В этом и состоит суть положения о равнораспределении энергии по степеням свободы. Из этого предположения следует, чем сложнее молекула, тем больше число её степеней свободы, тем больше среднее значение энергии одной молекулы
В этом и состоит суть положения о равнораспределении энергии по степеням свободы. Из этого предположения следует, чем сложнее молекула, тем больше число её степеней свободы, тем больше среднее значение энергии одной молекулы  ; здесь
; здесь  – сумма поступательных, вращательных и колебательных степеней свободы
– сумма поступательных, вращательных и колебательных степеней свободы  . Из школьного курса известно, молекула кислорода, азота состоит из двух атомов, соответственно,
. Из школьного курса известно, молекула кислорода, азота состоит из двух атомов, соответственно,  .
.
Барометрическая формула
До сих пор мы рассматривали идеальный газ в состоянии теплового равновесия как совокупность реальных частиц испытывающих столкновения и подчиняющихся законам динамики системы частиц. Перейдём к учёту воздействий на идеальный газ внешних полей. Будем рассматривать их в одночастичном приближении. В этом приближении идеальный газ может быть представлен совокупностью свободных «квазичастиц» индивидуального типа, каждая из которых движется независимо с эффективной скоростью, вообще не участвуя в каких-либо столкновениях. При таком подходе включение внешнего поля сопровождается движением каждой из квазичастиц в этом поле. Задача состоит в том, чтобы выяснить, как воздействие внешних полей сказывается на характеристиках газа в целом.
Поскольку взаимодействие в газах не является сильным и можно воспользоваться одночастичным приближением, дополним его приближением «среднего поля». Согласно этому приближению взаимодействие частиц можно учесть, перейдя от совокупности взаимодействующих «квазичастиц» к совокупности независимых «квазичастиц», движущихся в некоем внешнем «среднем поле». Учёт такого взаимодействия также оказывает воздействие на свойства газа в целом.
Итак, мы помещаем газ в потенциальное внешнее поле. Для простоты пусть это будет поле тяготения вблизи поверхности Земли. Его можно считать однородным. Действительно, по закону тяготения Ньютона тела притягиваются к Земле с силой  . Здесь G – постоянная всемирного тяготения, равная 6,67×10–11 (Н×м2) / кг2; R и МЗ – соответственно, радиус и масса Земли; m – масса элемента газа. На высоте h от поверхности Земли выражение силы принимает вид:
. Здесь G – постоянная всемирного тяготения, равная 6,67×10–11 (Н×м2) / кг2; R и МЗ – соответственно, радиус и масса Земли; m – масса элемента газа. На высоте h от поверхности Земли выражение силы принимает вид:  . Найдём разность силы тяжести на поверхности Земли и на высоте h от поверхности Земли, т.е.
. Найдём разность силы тяжести на поверхности Земли и на высоте h от поверхности Земли, т.е.  . Набравшись терпения и проведя преобразования, читатель получит аналитическое выражение вида:
. Набравшись терпения и проведя преобразования, читатель получит аналитическое выражение вида:  . Возводя в квадрат в числителе второго множителя, и проведя ещё раз преобразования, получим выражение вида;
. Возводя в квадрат в числителе второго множителя, и проведя ещё раз преобразования, получим выражение вида;  . Проанализируем выражение в скобках. Если учтём, что атмосферный слой простирается до 25÷30 км, а радиус Земли R порядка 6400 км, немедленно получаем – второе слагаемое в скобках ~ 2×10–5. Читатель может самостоятельно убедиться в том, что первое слагаемое в скобках не превышает 1×10–2. Таким образом, разность силы тяжести на высоте 30 км составляет порядка одной сотой от силы тяжести на поверхности Земли. Если высота h составляет десятки или сотни метров, то разность силы тяжести будет ещё меньше, что даёт основания считать поле тяготения вблизи поверхности Земли однородным. Однако теперь закон Паскаля о постоянстве давления для выделенного элементарного объёма газа D V, помещённого в потенциальное внешнее поле Земли, справедлив только в направлениях, где поле Земли отсутствует (рис. 5.2.).
. Проанализируем выражение в скобках. Если учтём, что атмосферный слой простирается до 25÷30 км, а радиус Земли R порядка 6400 км, немедленно получаем – второе слагаемое в скобках ~ 2×10–5. Читатель может самостоятельно убедиться в том, что первое слагаемое в скобках не превышает 1×10–2. Таким образом, разность силы тяжести на высоте 30 км составляет порядка одной сотой от силы тяжести на поверхности Земли. Если высота h составляет десятки или сотни метров, то разность силы тяжести будет ещё меньше, что даёт основания считать поле тяготения вблизи поверхности Земли однородным. Однако теперь закон Паскаля о постоянстве давления для выделенного элементарного объёма газа D V, помещённого в потенциальное внешнее поле Земли, справедлив только в направлениях, где поле Земли отсутствует (рис. 5.2.).
| Рис. 5.2 |
 Действительно, на каждую частицу выделенного объёма газа D V в направлении оси Z теперь действует сила тяготения
Действительно, на каждую частицу выделенного объёма газа D V в направлении оси Z теперь действует сила тяготения  , направленная в противоположную оси Z
, направленная в противоположную оси Z | Z |
 – масса частицы. Учитывая, что на элемент объёма газа D V действует сила m × g = –
– масса частицы. Учитывая, что на элемент объёма газа D V действует сила m × g = –  × n ×D V × g, где m – масса объёма газа D V, выраженная через концентрацию частиц n и объём выделенного элемента газа
× n ×D V × g, где m – масса объёма газа D V, выраженная через концентрацию частиц n и объём выделенного элемента газа  , условие равновесия сил, действующих на элемент D V объёма газа в направлении оси Z, примет вид: – m о× n ×D V × g =
, условие равновесия сил, действующих на элемент D V объёма газа в направлении оси Z, примет вид: – m о× n ×D V × g =  , здесь
, здесь  – давление окружающего газа на нижний уровень S выделенного объёма газа D V (см. рис. 5.2.);
– давление окружающего газа на нижний уровень S выделенного объёма газа D V (см. рис. 5.2.);  – давление окружающего газа на верхний уровень выделенного объёма D V;
– давление окружающего газа на верхний уровень выделенного объёма D V;  – площадь основания элемента D V объёма; знак «–» обусловлен тем, что направление силы тяготения
– площадь основания элемента D V объёма; знак «–» обусловлен тем, что направление силы тяготения  противоположно направлению оси Z (см. рис.5.2.), тогда как разность давлений окружающего газа на верхнюю и нижнюю грани объёма D V создаёт силу давления
противоположно направлению оси Z (см. рис.5.2.), тогда как разность давлений окружающего газа на верхнюю и нижнюю грани объёма D V создаёт силу давления  , направленную в положительном направлении оси Z, т.е. вверх.
, направленную в положительном направлении оси Z, т.е. вверх.Почему сила давления  окружающего газа на выделенный элемент объёма D V направлена вверх? На с. 53 показано,
окружающего газа на выделенный элемент объёма D V направлена вверх? На с. 53 показано,  ; отсюда следует, только два параметра определяют давление газа – концентрация молекул газа n и его температура Т. Ранее, на с. 54, показано, температура Т среды определяет энергию поступательного движения молекул газа. Наш жизненный опыт подтверждает, численное значение температуры вблизи поверхности Земли в данном месте относительно постоянно по высоте. Естественно предположить, величина давления р «чувствительна» к концентрации молекул газа n в единице объёма. Если учесть рассуждения данного абзаца, условие равновесия сил на элемент объёма газа D V принимает вид: – m о× n ×D V × g =
; отсюда следует, только два параметра определяют давление газа – концентрация молекул газа n и его температура Т. Ранее, на с. 54, показано, температура Т среды определяет энергию поступательного движения молекул газа. Наш жизненный опыт подтверждает, численное значение температуры вблизи поверхности Земли в данном месте относительно постоянно по высоте. Естественно предположить, величина давления р «чувствительна» к концентрации молекул газа n в единице объёма. Если учесть рассуждения данного абзаца, условие равновесия сил на элемент объёма газа D V принимает вид: – m о× n ×D V × g =  =
=  . Так как D z мало, следует ожидать, разность концентраций частиц по высоте (рис. 5.2.) с координатами z и z+Dz может быть записана
. Так как D z мало, следует ожидать, разность концентраций частиц по высоте (рис. 5.2.) с координатами z и z+Dz может быть записана  . Аналитическая запись условия равновесия сил принимает конечный вид:
. Аналитическая запись условия равновесия сил принимает конечный вид:  . Читатель, рассуждая, должен пояснить себе, при каком соотношении числовых значений
. Читатель, рассуждая, должен пояснить себе, при каком соотношении числовых значений  сила давления окружающего газа на выделенный элемент объёма D V совпадает с направлением оси Z (подсказку можно усмотреть на рис.5.2.).
сила давления окружающего газа на выделенный элемент объёма D V совпадает с направлением оси Z (подсказку можно усмотреть на рис.5.2.).
Проанализируем условие равновесия сил на выделенный элемент объёма газа  :
:  ; здесь
; здесь  – масса квазичастицы газа; k – постоянная Больцмана, численное значение которой приведено на с. 53; S –площадь выделенного элемента объёма газа
– масса квазичастицы газа; k – постоянная Больцмана, численное значение которой приведено на с. 53; S –площадь выделенного элемента объёма газа  , находящегося во внешнем силовом поле; Т и g, соответственно, характеристики температурного поля среды и внешнего силового поля. Если учесть, что
, находящегося во внешнем силовом поле; Т и g, соответственно, характеристики температурного поля среды и внешнего силового поля. Если учесть, что  , то после несложных преобразований уравнения равновесия читатель самостоятельно может получить формулу вида:
, то после несложных преобразований уравнения равновесия читатель самостоятельно может получить формулу вида:  . Из неё следует, скорость изменения концентрации газа с высотой определяется концентрацией частиц в единице объёма n и отношением между силовым и потенциальным полем. Переходя к бесконечно малым величинам
. Из неё следует, скорость изменения концентрации газа с высотой определяется концентрацией частиц в единице объёма n и отношением между силовым и потенциальным полем. Переходя к бесконечно малым величинам  , формула принимает вид:
, формула принимает вид:  ; получили уравнение в дифференциальной форме. Данное уравнение позволяет найти зависимость концентрации частиц в атмосфере у поверхности Земли в условиях теплового равновесия. Действительно, разделяя переменные
; получили уравнение в дифференциальной форме. Данное уравнение позволяет найти зависимость концентрации частиц в атмосфере у поверхности Земли в условиях теплового равновесия. Действительно, разделяя переменные  и проводя интегрирование
и проводя интегрирование  , получаем уравнение вида:
, получаем уравнение вида:  ; здесь n и z
; здесь n и z  переменные, символы у интегралов сверху и снизу показывают, соответственно, максимальное и минимальное значение, принимаемое переменными. Подставляя эти значения в уравнение, получаем аналитическое выражение вида:
переменные, символы у интегралов сверху и снизу показывают, соответственно, максимальное и минимальное значение, принимаемое переменными. Подставляя эти значения в уравнение, получаем аналитическое выражение вида:  ; если учесть, что разность логарифмов равна логарифму частного, выражение запишется:
; если учесть, что разность логарифмов равна логарифму частного, выражение запишется: 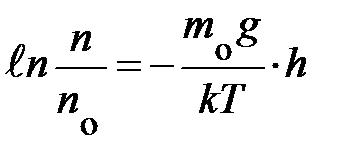 . Наконец, проведя последнюю математическую операцию – потенцирование, получаем формулу, характеризующую зависимость концентрации частиц в атмосфере у поверхности Земли в условиях теплового равновесия:
. Наконец, проведя последнюю математическую операцию – потенцирование, получаем формулу, характеризующую зависимость концентрации частиц в атмосфере у поверхности Земли в условиях теплового равновесия:  . Из неё следует – «борьба» между внешним потенциальным полем и тепловым определяет распределение частиц в атмосфере; чем меньше потенциальная энергия молекул, тем больше их плотность.
. Из неё следует – «борьба» между внешним потенциальным полем и тепловым определяет распределение частиц в атмосфере; чем меньше потенциальная энергия молекул, тем больше их плотность.
Учитывая, что закон Клапейрона-Менделеева справедлив для любой точки формула распределения концентрации частиц может быть переписана для давления газа в атмосфере у поверхности Земли. Действительно,  . Полученная формула называется барометрической.
. Полученная формула называется барометрической.
Повторяя те же рассуждения, формула распределения концентрации частиц во внешнем поле может быть обобщена на произвольное потенциальное поле; в дальнейшем нам с этим придётся встретиться. Формулу для концентрации частиц во внешнем поле в условиях теплового равновесия принято называть формулой Больцмана:  .
.
Завершая экскурс в раздел «Тепловые явления. Термодинамический и статистический методы исследования», перечислим его ключевые понятия: термодинамическая система, макро- и микропараметры системы, состояние системы, «квазичастица» индивидуального типа, идеальный газ, основное уравнение кинетической теории газов; тепловое равновесие, понятие температуры (эмпирической), степень свободы молекулы, равнораспределение энергии по степеням свободы; идеальный газ во внешнем поле, барометрическая формула, распределение Больцмана.






