Дисперсные системы – это гетерогенные системы, состоящие из большого числа очень малых частиц раздробленного вещества или тончайших пор и окружающей их сплошной среды. Раздробленное вещество или поры образуют дисперсную фазу, сплошная часть системы – дисперсионную среду. Дисперсная фаза и дисперсионная среда должны быть взаимно нерастворимы.
В зависимости от степени раздробленности частиц дисперсные системы подразделяются на грубодисперсные с размером частиц порядка
10–4–10–6м и высокодисперсные или коллоидные системы, имеющие частицы размером 10–7–10–9 м.
Далее будем рассматривать только высокодисперсные системы с жидкой дисперсионной средой и твердой дисперсной фазой. Такие системы называются коллоидными растворами или золями.
Для коллоидных систем частицы дисперсной фазы значительно больше молекул, из которых состоит дисперсионная среда. Это приводит к появлению поверхности раздела между частицами и средой. Такие системы являются микрогетерогенными. Далее по степени раздробленности идут истинные (молекулярные) растворы. Это уже гомогенные системы, в которых одно вещество распределено в другом в виде молекул, атомов или ионов.
Коллоидные частицы не видны в световой микроскоп, не задерживаются бумажными фильтрами, долго не оседают.
В зависимости от характера взаимодействия дисперсной фазы и дисперсионной среды коллоидные системы подразделяются на лиофобные (в случае водной дисперсионной среды гидрофобные) и лиофильные (гидрофильные).
К лиофобным коллоидам относятся системы, в которых частицы дисперсной фазы не взаимодействуют или слабо взаимодействуют с дисперсной средой. Эти системы получают с затратой энергии, и они устойчивы лишь в присутствии стабилизаторов.
У лиофильных коллоидов велико сродство между дисперсной фазой и дисперсионной средой. Такие системы образуются самопроизвольно, благодаря сильному взаимодействию дисперсной фазы с дисперсной средой. Примерами таких систем являются коллоидные растворы мицеллярных ПАВ.
Методы получения гидрофобных золей подразделяются на три группы: методы диспергирования (измельчение вещества до частиц коллоидных размеров), методы пептизации (разъединение слипшихся частиц), методы конденсации (объединение атомов, молекул или ионов в коллоидные частицы).
К методам диспергирования относятся: механическое дробление в коллоидных мельницах, применение для измельчения вещества ультразвука и вольтовой дуги. Образующиеся частицы имеют тенденцию к слипанию (коагуляции), поэтому дробление ведут в дисперсионной среде в присутствии стабилизаторов (электролиты или ПАВ).
При пептизации (физико-химическое дробление) не происходит изменения степени дисперсности частиц. Ионы пептизатора адсорбируются на поверхности коллоидных частиц, заряжая их одноименно, что обеспечивает электростатическое отталкивание и переход частиц во взвешенное состояние. Так образуется золь.
Конденсация бывает физическая и химическая. Физическая конденсация может быть осуществлена при пропускании паров одного вещества (дисперсная фаза) в другое (дисперсионная среда) в присутствии стабилизатора, либо методом замены растворителя: раствор какого-либо вещества постепенно прибавляют при перемешивании к жидкости, в которой это вещество нерастворимо. При этом происходит конденсация молекул и образование коллоидных частиц. Так получают гидрозоли серы, фосфора, канифоли, антрацена при вливании их спиртовых растворов в воду.
Гидрофобные золи можно получить и методом химической конденсации.
Если в результате химической реакции образуется трудно растворимое соединение, то оно при определенных условиях может быть получено в виде коллоидного раствора. Для этого нужно, во-первых, проводить реакцию в разбавленном растворе, чтобы скорость роста кристаллических частиц была невелика, тогда частицы получаются мелкие (10-7-10-9м), во-вторых, необходимо одно из реагирующих веществ взять в избытке, чтобы на поверхности кристалла мог образоваться двойной электрический слой – основной фактор агрегативной устойчивости.
Кристалл вместе с двойным электрическим слоем (ДЭС) называется мицеллой.
Рассмотрим строение мицеллы лиофобного золя на примере образования коллоидного раствора иодида серебра при сливании разбавленных растворов нитрата серебра и иодида калия, причем KI взят в избытке и выполняет функцию стабилизатора. Иодид серебра образуется в результате обменной реакции:
AgNO3+KI=AgI ¯ +KNO3.
Микрокристалл малорастворимого иодида серебра, состоящий из m частиц AgI, называется агрегатом. На поверхности агрегата могут избирательно адсорбироваться ионы из раствора, причем в первую очередь адсорбируются те из них, которые присутствуют в избытке и родственны составу агрегата (правило Панета-Фаянса). В нашем примере – это анионы I–. Их называют потенциалопределяющими ионами. Допустим их n. Агрегат вместе с потенциалопределяющими ионами является частицей твердой фазы и называется ядром.
За счет электростатического притяжения анионы I– будут удерживать возле себя катионы калия, которые также присутствуют в избытке. Эти катионы называются противоионами. Противоионы, наиболее близко расположенные к ядру, находятся в слое жидкости, смачивающей его поверхность, и испытывают не только электростатическое, но и ван-дер-ваальсово притяжение ядра. Поэтому эти ионы наиболее прочно связаны с ядром. Они называются противоионами адсорбционной сферы. Однако их количество недостаточно для полной нейтрализации суммарного заряда потенциалопределяющих ионов. Образование, состоящее из ядра и адсорбционной сферы противоионов, носит название коллоидной частицы или гранулы. Она несет заряд, равный алгебраической сумме зарядов ионов адсорбционной сферы.
Остальные противоионы, слабее связанные с ядром, под действием теплового движения располагаются в жидкой фазе диффузно, то есть размыто. Они образуют диффузную сферу, нейтрализуя заряд коллоидной частицы.
Гранула в совокупности с диффузной сферой противоионов образуют мицеллу. Мицелла электронейтральна. Схематично строение мицеллы рассматриваемого золя приведено на рисунке 2.9.1.
{ [AgI]m, n I–, (n-x) K+ } x – x K+




 агрегат потенциал- противоионы противоионы
агрегат потенциал- противоионы противоионы



 определяющие адсорбционной диффузной
определяющие адсорбционной диффузной
ионы сферы сферы
ядро
 коллоидная частица (гранула)
коллоидная частица (гранула)

мицелла

Рисунок 2.9.1 – Схема строения мицеллы золя AgI при избытке KI
Если рассматриваемую реакцию проводить в условиях избытка AgNO3, то формируется другой ДЭС. Тогда формула мицеллы выглядит следующим образом:
{ [AgI]m, n Ag+, (n-x) NO3– } x+ x NO3–
При движении дисперсной фазы относительно дисперсионной среды граница скольжения проходит вблизи раздела между адсорбционным и диффузным слоем противоионов. То есть гранула движется как целое, а диффузный слой противоионов непрерывно переформировывается во время движения.
Процесс укрупнения коллоидных частиц в результатеих слипания под действием межмолекулярных сил притяжения называется коагуляцией.
Процессу коагуляции золя способствуют вибрация, нагревание, замораживание, пропускание электрического тока, длительное стояние (старение золя), прибавление электролита.
Под действием электролита наиболее легко коагулируют золи, у которых основным фактором устойчивости является ДЭС. Коагуляция сопровождается помутнением золя, образованием хлопьев осадка или геля (дисперсной системы с жидкой дисперсионной средой, в которой мицеллы образуют пространственную структурную сетку).
В соответствии с правилом Шульце–Гарди, коагуляцию вызывают ионы электролита, несущие заряд, противоположный по знаку заряду коллоидной частицы, причем коагулирующее действие электролита сильно возрастает с ростом заряда иона-коагулятора.
Минимальная концентрация электролита (может выражаться в моль/л, ммоль/л, кмоль/м3), вызывающая быструю (явную) коагуляцию золя, называется порогом коагуляции. Порог коагуляции СК, выраженный в моль/л, может быть рассчитан по формуле:
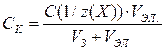 , (2.9.1)
, (2.9.1)
где С(1/z(X)) – молярная концентрация эквивалента электролита Х, моль/л;
VЭЛ.. и VЗ – объемы электролита и золя соответственно, л.
Теоретические расчеты показывают, что порог коагуляции золя электролитом СК обратно пропорционален заряду иона-коагулянта Z в шестой степени:
СК= K/Z6,
где К — постоянная для данного золя величина.
Если принять порог коагуляции трехзарядного иона за единицу, то для соотношения порогов коагуляции ионов с различными зарядами можно записать приближенно:
СK(z=1):CK(z=2):CK(z=3)»730:11:1
В реальных системах могут наблюдаться отклонения от приведенных цифр, но порядки величин сохраняется.
При сливании коллоидных растворов с противоположными зарядами частиц, может происходить взаимная коагуляция. Ее можно рассматривать как частный случай коагуляции электролитами, когда вместо ионов-коагуляторов коагуляцию золя вызывают коллоидные частицы, имеющие противоположный заряд.
Пример 1
Пороги коагуляции золя электролитами оказались равными (моль/л): Cк(NaNO3) =0,25; Cк(Fe(NO3)3)=0,0005; Cк(Mg(NO3)2)=0,02. Определите ионы-коагуляторы для этих электролитов. Как заряжены частицы золя?
Решение
Все применяемые в качестве коагулянтов электролиты содержат нитрат-анион. Если бы коагулирующей способностью обладали анионы коагулянта, то пороги коагуляции для всех электролитов были бы одинаковыми. Однако, в ряду Na+, Mg2+, Fe3+ значения порогов коагуляции резко уменьшаются. То есть, с ростом заряда катиона коагулянта порог коагуляции падает. Как известно, коагулирующей активностью обладают ионы, противоположно заряженные по отношению к коллоидным частицам, поэтому можно заключить, что коллоидные частицы изучаемого золя имеют отрицательный заряд, а ионами-коагуляторами являются катионы электролита.
Пример 2
Золь кремниевой кислоты Н2SiO3 был получен при взаимодействии растворов К2SiO3 и HCI. Напишите формулу мицеллы золя и определите, какой из электролитов был в избытке, если противоионы в электрическом поле движутся к катоду?
Решение
Золь получают методом химической конденсации по реакции
К2SiO3 + 2 HCI = Н2SiO3 ¯ +2KCl
Если противоионы движутся к катоду, то они имеют положительный заряд, а коллоидная частица – отрицательный. Следовательно, потенциалопределяющими ионами в процессе мицеллообразования являются отрицательно заряженные анионы SiO32-, то есть в избытке был взят силикат калия.
Формула мицеллы золя:
{[ H2SiO3 ] m; n SiO32–; 2(n-x) K+ } 2x – 2x K+
Пример 3
Какой объем 0,0025 М раствора КI надо добавить к 0,035 л 0,003 н. раствора Рb(NO3) 2, чтобы получить золь иодида свинца, коллоидные частицы которого двигались бы к аноду при электрофорезе? Напишите формулу мицеллы золя.
Решение:
Золь получают методом химической конденсации по реакции
2КI+ Рb(NO3) 2= PbI2 ¯ +2KNO3
Из условия следует, что коллоидные частицы заряжены отрицательно. Значит, при образовании золя в избытке был взят иодид калия. Мицелла имеет формулу
{[ PbI2 ] m, n I–, (n-x) K+ } x – x K+
К раствору Рb(NO3) 2 нужно добавить такой объем раствора КI, который бы превышал эквивалентный объем.
Пользуясь законом эквивалентов, можно рассчитать объем раствора КI в точке эквивалентности.
V1C1(1/z) = V2C2(1/z).
V(KI) = V(Рb(NO3)2) · C(1/z Рb(NO3)2): C(1/z KI) = 0,035·0,003:0,0025=0,042 л
Итак, объем 0,0025М КI должен превышать 0,042 л.






