DТкип=.КЭб·b, (2.4.12)
где КЭб – эбулиоскопическая постоянная растворителя;
b – моляльная концентрация.
Понижение температуры замерзания раствора
DТз.=Кк·b, (2.4.13)
где Кк – криоскопическая постоянная растворителя;
b – моляльная концентрация.
Закон Вант-Гоффа для осмотического давления
p=СRT, (2.4.14)
где С – молярная концентрация раствора;
R – универсальная газовая постоянная;
T – абсолютная температура.
Если в формулу (2.4.14) подставлять молярную концентрацию, выраженную в моль/л, то осмотическое давление будет выражено в кПа.
Пример 1
Рассчитать массу CuSO4 и объем воды, необходимые для приготовления
130 мл 8% раствора этой соли. Рассчитать молярную, моляльную, нормальную концентрации и титр раствора. Плотность 8% раствора CuSO4 равна
1,084 г/cм3 (г/мл).
Решение
 ,
,
m(р-ра)= r×V
m(CuSO4)= 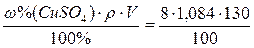 =11,37 (г)
=11,37 (г)
m(H2O)=m(р-ра)-m(CuSO4)= r×V - m(CuSO4)= 1,084×130-11,37=129,55(г).
Так как при комнатной температуре плотность воды близка к 1 г/см3, то масса воды, выраженная в граммах, численно равна ее объему в мл. Итак, объем воды равен 129,55 мл.
Рассчитаем молярную концентрацию раствора:


Нормальная концентрация:
 .
.
Моляльная концентрация:


Титр раствора:


Пример 2
Какова молярная масса вещества, 24,731 г которого растворено в 1 л воды, если раствор замерзает при –0,5 0С, а криоскопическая постоянная для воды равна 1,86  ?
?
Решение
DТз=Кк·b,

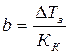 ,
,
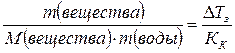 ,
,
Будем считать плотность воды равной 1 кг/л. Тогда масса воды равна 1 кг.

Ответ: молярная масса вещества равна 92 г/моль.
Пример 3
Рассчитайте массу глюкозы (С6Н12О6), которая содержится в 100 мл раствора с осмотическим давлением 260 кПа при 5 0С.
Решение
Из формулы (2.4.14) выразим и рассчитаем молярную концентрацию раствора.

Рассчитаем массу глюкозы в 100 мл раствора:
m (С6Н12О6)= C · M (С6Н12О6)· V =0,113 моль/л ·180 г/моль ·0,1 л = 2,03 г
Пример 4
Каково процентное содержание глюкозы (С6Н12О6) в водном растворе, если понижение давления водяного пара над раствором составило 2,5% от давления пара над чистой водой.
Решение
В соответствии с условием задачи, понижение давления пара растворителя над раствором составит определенную долю от давления пара над чистым растворителем, то есть 0,025 Р0 или 25% от Р0.
На основании закона Рауля

 ;
;
 .
.
Пусть для простоты имеется 100 г раствора глюкозы, тогда в нем содержится m граммов глюкозы и (100- m) граммов воды.

Решая данное уравнение относительно m, найдем массу глюкозы в 100 г раствора. Итак, масса глюкозы m =20,55 г.
Определим процентное содержание глюкозы в растворе:
 .
.
Пример 5
Рассчитайте температуру кипения водного раствора сахарозы (С12Н22О11), если его осмотическое давление при 27 0С составляет 15,6 кПа. Эбуллиоскопическая постоянная воды 0,52  .
.
Решение
Из уравнения Вант-Гоффа для осмотического давления (формула 2.4.14) выразим и рассчитаем молярную концентрацию раствора сахарозы.

Масса сахарозы в 1 л раствора:
m (C12H22O11)= M (C12H22O11)· ν =342 г/моль ·0,0063 моль =2,15 г.
Плотность такого разбавленного раствора можно считать равной плотности воды, то есть приблизительно 1 г/мл. Тогда масса воды в 1 л раствора сахарозы составит
m (H2O)= m (раствора) – m (C12H22O11)=1000 г – 2,15 г = 997,85 г
Рассчитаем повышение температуры кипения раствора сахарозы в соответствии с формулой (2.4.12).
DТкип=.КЭб·b = 
Температура кипения раствора сахарозы равна:
100 0С +0,003 0С =1 00,003 0С.






