Иным подходом к классификации веществ с точки зрения отнесения их к кислотам и основаниям явилась электронная теория Льюиса. В рамках электронной теории:
кислотой называют частицу (молекулу или ион), способную присоединять электронную пару (акцептор электронов);
основанием называют частицу (молекулу или ион), способную отдавать электронную пару (донор электронов).
Согласно представлениям Льюиса, кислота и основание взаимодействуют друг с другом с образованием донорно-акцепторной связи. В результате присоединения пары электронов у атома с электронным дефицитом возникает завершенная электронная конфигурация - октет электронов. Например:
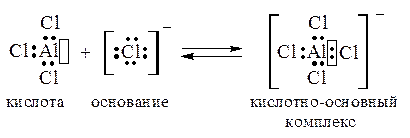
Аналогичным образом можно представить и реакцию между нейтральными молекулами:

Реакция нейтрализации в терминах теории Льюиса рассматривается как присоединение электронной пары гидроксид-иона к иону водорода, предоставляющему для размещения этой пары свободную орбиталь:

Таким образом, сам протон, легко присоединяющий электронную пару, с точки зрения теории Льюиса, выполняет функцию кислоты. В этой связи, кислоты по Бренстеду могут рассматриваться как продукты реакции между льюисовскими кислотами и основаниями. Так, HCl является продуктом нейтрализации кислоты H+ основанием Cl-, а ион H3O+ образуется в результате нейтрализации кислоты H+ основанием H2O.
Реакции между кислотами и основаниями Льюиса также иллюстрируют следующие примеры:
| Кислота | Основание | Кислотно-основный комплекс |
| SO2 | H2O | H2SO3 |
| Al(OH)3 | OH– | [Al(OH)4]– |
| Zn(OH)2 | 2OH– | [Zn(OH)4]2– |
| Ag+ | 2CN– | [Ag(CN)2]– |
К основаниям Льюиса также относят галогенид-ионы, аммиак, алифатические и ароматические амины, кислородсодержащие органические соединения типа R2CO, (где R - органический радикал).
К кислотам Льюиса относят галогениды бора, алюминия, кремния, олова и других элементов.
Очевидно, что в теории Льюиса понятие «кислота» включает в себя более широкий круг химических соединений. Это объясняется тем, что по Льюису отнесение вещества к классу кислот обусловлено исключительно строением его молекулы, определяющим электронно-акцепторные свойства, и не обязательно связано с наличием атомов водорода. Льюисовские кислоты, не содержащие атомов водорода, называют апротонными.






