Процесс диссоциации слабых электролитов является обратимым:
KtnAnm ⇄ nKtm+ + mAnn-
и характеризуется константой равновесия, которая в данном случае называется константой диссоциации:

| (2) |
Величина  зависит от природы электролита и растворителя, а также от температуры, но не зависит от концентрации раствора.
зависит от природы электролита и растворителя, а также от температуры, но не зависит от концентрации раствора.
Слабые одноосновные кислоты типа HA диссоциируют по общему уравнению:
HA ⇄ H+ + A-.
Константа диссоциации равна:

Здесь индекс a (acidum) указывает на кислотный тип диссоциации.
Например, для слабой кислоты HNO2 можно записать:
HNO2 ⇄ H+ + NO2-,

Аналогичным образом записывают константы диссоциации оснований:
NH3×H2O ⇄ NH4+ + OH-.

Индекс b (basicum) обозначает основный тип диссоциации.
Диссоциация многоосновных кислот (многокислотных осно-ваний) происходит в несколько ступеней, каждая из которых характе-ризуется своей константой.
Например, для фосфорной кислоты имеем:
| H3PO4 ⇄ H+ + H2PO4-, | 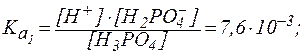
|
| H2PO4– ⇄ H+ + HPO42-, | 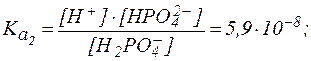
|
| HPO42– ⇄ H+ + PO43-, | 
|
Видно, что 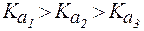 . Данное неравенство соблюдается для всех без исключения случаев ступенчатой диссоциации. Последовательное снижение величин констант диссоциации легко объяснимо: с увеличением отрицательного заряда иона отщепление каждого последующего протона становится все более энергоемким.
. Данное неравенство соблюдается для всех без исключения случаев ступенчатой диссоциации. Последовательное снижение величин констант диссоциации легко объяснимо: с увеличением отрицательного заряда иона отщепление каждого последующего протона становится все более энергоемким.
Суммарная константа диссоциации определяется соотношением:

Несложно видеть, что суммарная константа диссоциации  равна произведению констант диссоциации отдельных ступеней:
равна произведению констант диссоциации отдельных ступеней:

На практике вместо величин  и
и  часто используют значения
часто используют значения  и
и 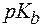 , которые рассчитываются следующим образом:
, которые рассчитываются следующим образом:
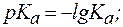

На основании значений  и
и  можно сделать заключение о сравнительной силе кислоты или основания:
можно сделать заключение о сравнительной силе кислоты или основания:
чем больше значение  (
(  ), тем сильнее кислота (основание);
), тем сильнее кислота (основание);
чем меньше значение  (
( 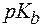 ), тем сильнее кислота (основание).
), тем сильнее кислота (основание).
Величины констант диссоциации для некоторых слабых электролитов представлены в таблице 1.
Таблица 1. Константы диссоциации некоторых слабых электро-литов при 298 К.
| Соединение | 
| 
| ||
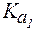
| 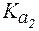
| 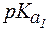
| 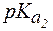
| |
| CH3COOH | 1,8×10-5 | - | 4,74 | - |
| HCN | 4,9×10-10 | - | 9,30 | - |
| H2S | 8,9×10-8 | 1,3×10-13 | 7,05 | 12,9 |

| 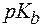
| |||

| 
| 
| 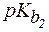
| |
| NH3×H2O | 1,8×10-5 | - | 4,74 | - |
| Pb(OH)2 | 9,6×10-4 | 3,0×10-8 | 3,0 | 7,5 |
Таким образом, при постоянной температуре сравнительную силу слабых электролитов определяют две величины: степень диссо-циации a и константа диссоциации  . Эти величины являются взаимосвязанными.
. Эти величины являются взаимосвязанными.
Действительно, для бинарного электролита, диссоциирующего по уравнению:
KtAn ⇄ Kt+ + An-
можно записать:
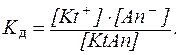
Представив
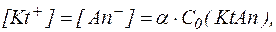
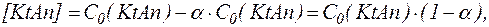
где С0(KtAn) – общая концентрация электролита, получим:

| (3) |
Данное соотношение выражает закон разведения Оствальда.
Для слабых электролитов a << 1, поэтому можно записать:

или:
 . .
| (4) |
Таким образом, закон Оствальда можно сформулировать следующим образом:
Степень диссоциации слабого электролита возрастает с разбавлением раствора.






