Квантовую теорию металлов создали в 30-х годах нашего столетия Френкель (СССР) и Зоммерфельд (Германия).

|
В классической физике считается, что все величины, характеризующие состояние частицы (тела) могут меняться непрерывно и принимать любые значения.
При квантомеханическом описании, напротив, оказывается, что ряд величин (энергия, импульс) может принимать только дискретные значения. Если, например, изобразить на диаграмме энергию, которую может иметь электрон в атоме, то получается набор линий, представляющий собой энергетические уровни свободного атома. Изолированный атом имеет дискретный энергетический спектр. Электроны подчиняются принципу запрета, сформулированному швейцарским физиком Паули:
На каждом энергетическом уровне может быть не более двух электронов с противоположно направленными спинами.
Spin— крутиться, собственный механический момент импульса электрона (связано с вращением электрона вокруг своей оси).
По этой причине при переходе от атома к атому происходит постепенное заполнение энергетических уровней.

|
Атом водорода, например, в нормальном состоянии имеет один электрон, находящийся на самом низком уровне; В атоме гелия второй электрон садится рядом на том же уровне с противоположным спином; третий электрон в атоме лития занимает самый низкий из свободных уровней — второй и т.д.
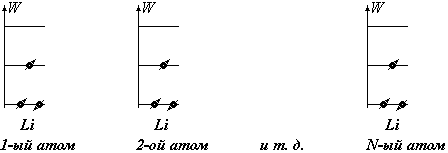
|
Пусть имеется N атомов одновалентного металла при Т = 0 К. Рассмотрим воображаемое тело, в котором эти N атомов находятся столь далеко друг от друга, что их взаимодействием можно пренебречь. Атом имеет один валентный электрон. Наше воображаемое тело, состоящее из N невзаимодействующих атомов, имеет на высшем уровне N электронов.
Теперь представим себе, что расстояние r между атомами уменьшается на столько, что на каждый электрон будет теперь действовать не только ядро собственного атома, но и ядра соседних атомов. Притягивая электрон, эти ядра ослабляют связь его в атоме, в результате чего возникает движение электронов от атома к атому, что приводит к обобществлению всех электронов на одном и том же энергетическом уровне. Взаимодействующие атомы представляют собой единую квантовую систему, в пределах которой действует принцип запрета Паули. При этом энергетические уровни расщепляются в почти непрерывные энергетические зоны. Больше всего подвержены возмущению внешние валентные электроны. При расщеплении валентных уровней образуется валентная зона.
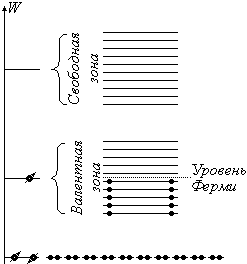
|
Расщеплением более низких уровней, на которых находятся внутренние электроны можно пренебречь. Пустая зона образуется при расщеплении свободного, не занятого уровня. В нашем случае валентная зона состоит из N подуровней, половина из которых занята электронами с противоположными спинами, в соответствии с принципом Паули.
Ширина зоны получается порядка нескольких электрон-вольт. Если N = NA, то расстояние между подуровнями в зоне ~10-23 эВ.
Обозначим энергию дна зоны через Wmin, потолка зоны через Wmax.
Wf — энергия уровня Ферми.
Уровень Ферми — это уровень, на котором находятся электроны, обладающие максимальной энергией в валентной зоне при Т = 0 К, т.е. это самый высокий уровень из занятых в валентной зоне.






